Любая система стремится перейти в состояние равновесия, которое является наиболее устойчивым состоянием системы.
Формулировка 2-го закона термодинамики.
Изобарно – изотермический потенциал химической реакции зависит не только от абсолютного количества вещества, но и от концентрации веществ, участвующих в реакции. Эта зависимость выражается в уравнении изотермы Вант – Гоффа.
аА + bВ = сС + dD
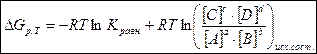 ,
, 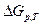 - изменение свободной энергии Гиббса при постоянном давлении и температуре.
- изменение свободной энергии Гиббса при постоянном давлении и температуре.
[C], [D], [А], [В] – концентрации веществ, участвующих в реакции.
R – универсальная газовая постоянная.
Т – абсолютная температура.
Кравн. – константа равновесия.
Изменяя концентрации веществ в исходном состоянии, можно изменить и DG реакции, т. е. добиться таким путём желаемого направления и глубины процесса.
Стандартное состояние: [C] = [D] = [А] = [В] = 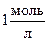 , температура = 298°К, давление = 101,325кПа.
, температура = 298°К, давление = 101,325кПа.
 2014-01-31
2014-01-31 901
901








