Все реакции можно разделить на две группы. В одних реакциях не меняется степень окисления атомов – это реакции обмена, некоторые реакции синтеза и распада веществ.
В других реакциях степень окисления атомов меняется. Это окислительно-восстановительные реакции. В них происходит переход электронов от одних атомов к другим, при этом изменяется степень окисления. Степень окисления - это число электронов, смещённых от одного атома к другому.
Если общие электронные пары не смещены ни к одному из атомов, то степень окисления равна нулю. Если же общая электронная пара смещена к одному из атомов, обладающему большей электроотрицательностью, то этот атом приобретает отрицательную степень окисления. Атом, от которого смещены электроны, приобретает положительную степень окисления.
Постоянную степень окисления +1 имеют щелочные металлы, постоянную степень окисления проявляют Zn2+, Ca2+, Al3+,O2-, H+(в соединениях с неметаллами), F-.
В окислительно-восстановительных реакциях происходят одновременно два процесса: окисление и восстановление.
Окислением называют процесс отдачи электронов, сопровождающийся повышением степени окисления.
Например, Zn0 + Cu2+SO4 = Cu0 + Zn2+SO4,
Zn0 - 2e = Zn2+ - процесс окисления
Zn0 - восстановитель.
Присоединение или взятие электронов, сопровождающееся понижением степени окисления, называют восстановлением.
Cu2+ + 2e = Cu0 – восстановление,
Сu2+- окислитель.
Восстановителями называют атомы или ионы, отдающие электроны и повышающие свою степень окисления.
Восстановителями могут быть атомы металлов, атомы неметаллов, имеющие низкие степени окисления в различных соединениях.
Пример:
Na2S4+O32-, S4+ – восстановитель.
NaN3+O2 , N3+ – восстановитель.
Fe2+Cl2, Fe2+ – восстаноситель.
H2S2-, S2- – восстановитель.
Окислителями называют атомы или ионы, принимающие электроны, и понижающие свою степень окисления.
Окислителями могут быть неметаллы с высокой электроотрицательностью. Например, галогены, кислород, а так же различные соединения, в которых атомы неметаллов и металлов находятся в высшей положительной степени окисления.
Пример:
H2S6+O4, S6+ – окислитель.
HN5+O3, N5+ – окислитель.
K2Cr26+O7, Cr6+ – окислитель.
KMn7+O4, Mn 7+– окислитель.
Типы окислительно-восстановительных реакций.
- межмолекулярные реакции. Связаны с изменением степени окисления атомов в разных молекулах.
2Mg0 + O20 = 2Mg2+O2-
Al0 + Fe3+ 2O3 = Fe0 + Al23+O3
- внутримолекулярные окислительно-восстановительные реакции. Происходит изменение степени окисления разных атомов в одной молекуле.
(N3-H4)2Cr27+O7 = N20 + Cr23+O3 + H2O
- реакции диспропорционирования. Реакции самоокисления, сомовосстановления. В этих реакциях одновременно происходит понижение и повышение степени окисления одного и того же элемента.
N4+O2 + H2O = HN3+O2 + HN5+O3
- реакции контрдиспропорционирования. Это внутримолекулярные реакции, в которых происходит выравнивание степеней окисления элементов.
(N3-H4)2N3+O2 = N20 + H2O
Влияние среды на характер реакции:
а) Нередко от среды зависят продукты взаимодействия:
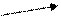 Mn2+ - в кислой среде
Mn2+ - в кислой среде
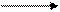 MnO MnO2 – в нейтральной среде
MnO MnO2 – в нейтральной среде
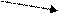 MnO – в щелочной среде
MnO – в щелочной среде
Для создания кислой среды используют разбавленную серную кислоту. Для создания щелочной среды берут сильные щёлочи.
б) Часто влияние среды проявляется в том, что некоторые элементы в одной и той же степени окисления могут существовать в разных формах в зависимости от среды:
K2Cr6+O4 – хромат (щелочная среда)
K2Cr26+O7 - дихромат (кислая среда).
Cr3+ - в кислой среде,
[Сr(OH)6]3- - в щелочной среде.
Составление уравнений окислительно-восстановительных реакций.
Любая окислительно-восстановительная реакция состоит из двух полуреакций: окисления и восстановления.
Условием для окислительно-восстановительной реакции является равенство числа отданных и принятых электронов.
Рассмотрим общие правила составления уравнений окислительно-восстановительных реакций методом электронно-ионного баланса на примере взаимодействия иодоводорода с концентрированной серной кислотой:
2HI + H2S6+O4 (к) = I20 + H2S4+O3 + H2O
1) Выявить роль участников процесса:
HI – восстановитель, H2SO 4 (к) – окислитель.
2) Составить электронно-ионные уравнения полуреакций:

 1 2HI - 2e = I20 + 2H+ окисление
1 2HI - 2e = I20 + 2H+ окисление
HI - восстановитель
1 SO42- + 2e +2H + = SO32- + H2O восстановление
SО42- - окислитель.
2НI+ SO42- + 2H+ = I20 + SO32- + H2O + 2Н+– суммарное ионное уравнение. Подобные члены в левой и правой частях уравнения сокращаем (2Н+) и переносим коэффициенты в молекулярное уравнение.
 2014-01-31
2014-01-31 823
823








