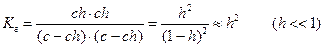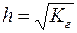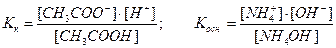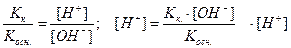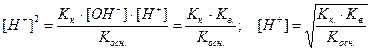Гидролиз – это взаимодействие веществ с водой.
Гидролиз можно охарактеризовать степенью гидролиза: h
Степень гидролиза зависит:
- от природы соли и выражается константой гидролиза,
- от концентрации,
- от температуры (чем выше температура, тем больше степень гидролиза).
Соли полностью, необратимо диссоциируют в растворе на ионы. При этом, если соль образована сильным основанием и сильной кислотой, то образованные в растворе ионы не вступают во взаимодействие с водой и не образуют с ней сложных веществ. Концентрация ионов гидроксила и ионов водорода не меняется, т.е. pH» 7 (среда нейтральная).
Пример: NaCl = Na+ + Cl- - это не гидролизующиеся соли.
1) Рассмотрим соли, образованные слабой кислотой и сильным основанием:
NaNO2, CH3COONa, HCOOK (формиат калия), Na3PO4
CH3COONa = CH3COO- + Na+
С водой будет взаимодействовать анион слабой кислоты
CH3COO- + H2O «CH3COOH + OH- (накапливаются ионы гидроксила).
В растворах этих солей pH > 7 (среда щелочная).
| |||
|
Равновесие гидролиза характеризуется константой гидролиза. Подставим в это выражение концентрацию ионов гидроксила, выраженную через ионное произведение воды: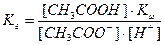
В этом уравнении 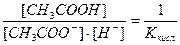 , отсюда получаем
, отсюда получаем
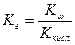 - константа гидролиза соли, образованной слабой кислотой и сильным основанием
- константа гидролиза соли, образованной слабой кислотой и сильным основанием
Расчет степени гидролиза:
c - ch ch ch
CH3COO - + H2O «CH3COOH + OH -
c – исходная концентрация соли;
h – степень гидролиза;
ch – концентрация прогидролизовавшихся молекул.
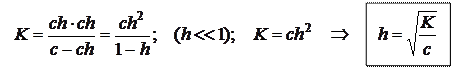 |
Расчет рН среды:
A - +H2O «HA + OH -; (A – анионы кислоты)
|
[HA] = [OH-] (h<<1)
|
[OH-]×[H+] = 10-14pOH = - lg[OH-] (pH = 14 – pOH).
2) Рассмотрим соли, образованные сильной кислотой и слабым основанием:
NH4OH, NH4Cl, NH4NO3, CuSO4
NH4Cl = NH4+ + Cl-
NH4+ +H2O «NH4OH + H+
В растворах этих солей pH < 7 (среда кислая).
Напишем выражение для константы равновесия этой реакции:
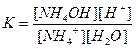 ,
, 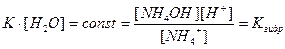
Подставив в это уравнение выражение для [H+] через ионное произведение воды, получаем
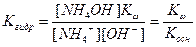
|
Степень гидролиза:
Расчет рН раствора:
c - ch ch ch
NH4+ + H2O «NH4OH + H+
|
Пример: рассчитать степень гидролиза нитрата аммония и pH раствора, где См=0,1моль/л,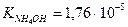
Кг. = Кω/Косн. = 10-14/1,76×10-5 = 5,7×10-10 (константа гидролиза)
| |||||
| |||||
|
pH = - lg 7,55 ×10 –6 = 5,1
3) Соли, образованные слабым основанием и слабой кислотой:
CH3COONH4 (ацетат аммония), NH4CN (цианид аммония), NH4HCOO (формиат аммония).
CH3COONH4 = CH3COO - + NH4+
c – ch c – ch ch ch
CH3COO - + NH4+ + H2O «CH3COOH + NH4OH
В растворах этих солей pH» 7 (среда нейтральная).
Если же константы диссоциации кислоты и основания сильно различаются, среда не будет нейтральной, например:
NH4CN + H2O «NH4OH + HCN
К(NH 4 OH) = 10-5; K(HCN) = 6,2×10-10
Гидролиз будет идти сильнее по аниону:
NH4+ + H2O «NH4OH + H+ [OH-] > [H + ]
CN- + H2O «HCN + OH-
Напишем выражение для константы равновесия гидролиза ацетата аммония:
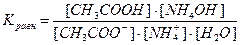 , здесь
, здесь 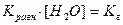 , тогда, умножив и разделив константу гидролиза на ионное произведение воды, получаем:
, тогда, умножив и разделив константу гидролиза на ионное произведение воды, получаем:
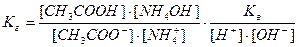 или
или
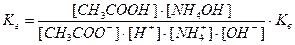 , откуда
, откуда
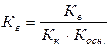
Расчет степени гидролиза:
|
|
Расчет рН:
|
Kк. ~ [H+]; Kосн. ~ [OH-]
| |||
|
 2014-01-31
2014-01-31 2131
2131

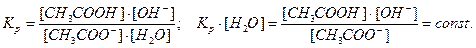
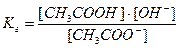 -
- 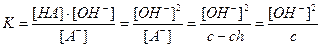
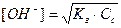
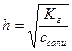
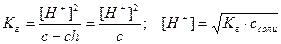
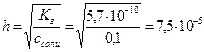
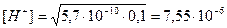 моль/л
моль/л