1. Кислотные свойства – оксикислоты дают все реакции, характерные для карбоксила: образование солей, сложных эфиров, амидов, галогенангидридов и т.п. Гидроксикислоты – более сильные электролиты, чем соответствующие им карбоновые кислоты (влияние гидроксильной группы).
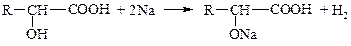
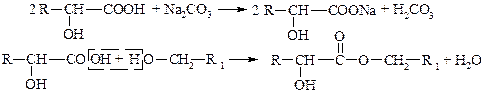
2. Спиртовые свойства – реакции замещения водорода гидроксигруппы, образование простых и сложных эфиров, замещение
–OH на галоген, внутримолекулярная дегидратация, окисление.
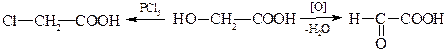
хлоруксусная гликолевая глиоксалевая
кислота кислота кислота
а) НО–СН2–СООН + СН3OH НО–СН2–СО–О–СН3 + Н2О
НО–СН2–СО–О–СН3 + Н2О
сложный эфир
гликолевой кислоты
и метилового спирта
б) НО–СН2–СООН + 2СН3ОН СН3–О–СН2–СООСН3 + 2Н2О
СН3–О–СН2–СООСН3 + 2Н2О
гликолевая метиловый метиловый эфир
кислота спирт метоксиуксусной кислоты
(полный эфир)
3. Отношение оксикислот к нагреванию – при нагревании
α-оксикислоты отщепляют воду, образуя циклический сложный эфир, построенный ид двух молекул α-оксикислот:
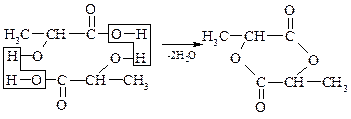
α-оксипропионовая кислота лактид
β-Оксикислоты в тех же условиях легко теряют воду с образованием непредельных кислот.
НО–СН2–СН2–СООН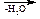 СН2=СН–СООН
СН2=СН–СООН
β-оксипропионовая акриловая кислота
кислота
γ-Оксикислоты тоже могут терять молекулу воды с образованием внутримолекулярных эфиров – лактонов.
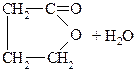
НО–СН2–СН2–СН2–СООН
γ-оксимасляная кислота
γ-бутиролактон
Некоторые оксикислоты получаются из природных продуктов. Так, молочную кислоту получают при молочно-кислом брожении сахаристых веществ. Синтетические способы получения основаны на следующих реакциях:
1) Cl–СН2–СООН + НОН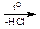 НО–СН2–СООН;
НО–СН2–СООН;
монохлоруксусная гликолевая
кислота кислота
2) СН2=СН–СООН + НОН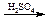 НО–СН2–СН2–СООН.
НО–СН2–СН2–СООН.
акриловая кислота β-оксипропионовая кислота
 2014-01-31
2014-01-31 913
913








