Для высокомолекулярных полипептидов и белков наряду с первичной структурой характерны более высокие уровни организации, которые принято называть вторичной, третичной и четвертичной структурами.
Вторичная структура описывается пространственной ориентацией основной полипептидной цепи, третичная – трехмерной архитектурой всей белковой молекулы. Как вторичная, так и третичная структуры связаны с упорядоченным расположением макромолекулярной цепи в пространстве. Вторичная структура закрепляется, как правило, с помощью водородных связей между пептидными группами, довольно близко расположенными в цепи α-аминокислотных остатков. Ее основные виды — α-спираль и β-структура. Третичная структура (глобулярная или фибриллярная) стабилизируется не только водородными связями, но и другими видами взаимодействий, например ионным, гидрофобным, а также «сульфидными» связями.
Первые три уровня характерны для структурной организации всех белковых молекул. Четвертый уровень встречается при образовании единых белковых комплексов, состоящих из нескольких полипептидных цепей.
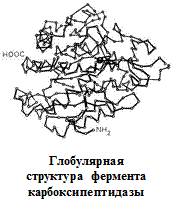
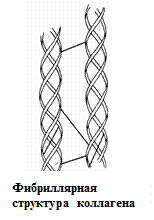
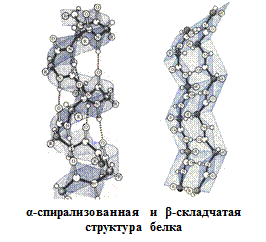 Определяющее значение в формировании более высоких уровней организации белковых молекул имеет их первичная структура. Природа α-аминокислотных остатков и порядок их соединения обусловливают характер стабилизации более высокоорганизованных структур.
Определяющее значение в формировании более высоких уровней организации белковых молекул имеет их первичная структура. Природа α-аминокислотных остатков и порядок их соединения обусловливают характер стабилизации более высокоорганизованных структур.
1. Из представленных соединений выберите изомер глутаминовой кислоты по функциональной группе
а) НООС–СН2СН2СН(ОН)–СОNH2; б) H2NCО–СН2СН2СН(NН2)–COOH;
в) HOOC–СН2CH(NH2)СН2–COOH; г) HOOC–СН2CH(NH2)–COOH.
2. Какую среду покажет раствор лизина при растворении в дистиллированной воде: а) нейтральную; б) слабокислую; в) слабощелочную?
3. Какая кислота образуется при дезаминировании валина in vitro:
а) 3-метил-2-оксобутановая; б) 3-метил-2-бутеновая; в) 2-метил-3-оксобутановая; г) 2-гидрокси-3-метилбутановая; д) 2-метилбутандиовая?
4. Какое органическое соединение получится из серина при действии на него фермента декарбоксилазы: а) 2-амино-1-этанол; б) 2-аминопропановая кислота; в) 3- гидроксипропановая кислота; г) 3-оксо-2-аминопропановая кислота; д) пропандиовая кислота?
5. Реакция на серусодержащие аминокислоты (реакция Фоля) меняет окраску раствора аминокислоты от бесцветной до: а) жёлтой, б) сине-фиолетовой, в) васильковой, г) чёрной.
6. При взаимодействии с конц. азотной кислотой раствор аминокислоты приобрёл жёлтый цвет, перешедший в оранжевый при подщелачивании (ксантопротеиновая реакция). Это был раствор: а) аланина, б) серина, в) аспарагина, г) тирозина, д) метионина?
7. Вторичная структура белка — это: а) последовательность аминокислотных остатков в полипептидной цепи; б) укладка полипептидной цепи в виде спирали или складчатой структуры; в) укладка полипептидной цепи в трёхмерную конфигурацию; г) комплекс из нескольких отдельных полипептидных цепей.
8. Закрепление конформации в третичной структуре белка происходит, в основном, за счёт связей: а) водородных; б) ионных; в) гидрофобных (силы Ван-дер-Ваальса); г) кислородных; д) азотных; е) дисульфидных.
9. Приведите структурную формулу лейцина и сокращённое обозначение его аминокислотного остатка. Назовите эту аминокислоту по правилам международной номенклатуры. Приведите (если это возможно) один изомер положения функциональной группы, один изомер функциональной группы и один изомер строения углеродного скелета. Изобразите L и D- энантиомеры.
 2014-01-31
2014-01-31 1142
1142
