Пример 1
Определять условия, при которых устанавливается химическое равновесие.
Определять возможность самопроизвольного протекания химических реакций в том или ином направлении;
ТЕРМОДИНАМИЧЕСКИЙ И КИНЕТИЧЕСКИЙ ПОДХОДЫ К ИЗУЧЕНИЮ ПОВЕДЕНИЯ ЗАГРЯЗНИТЕЛЕЙ В ОС
ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ
Таким образом, общее аккумулирование представляет собой результат комбинации различных путей поступления постороннего вещества и зависит от вклада каждой стадии в процесс усвоения, вида растения и физико-химических свойств вещества.
Превращения посторонних химических веществ – это изменения их химической структуры под действием факторов ОС. Если речь идет об абиотических факторах воздействия (кислород, свет и т.д.), то говорят об абиотических превращениях. Если превращения вызываются живыми организмами или продуцируемыми ими ферментами, то говорят о биотических превращениях. Биотические превращения посторонних химических веществ часто называют в экологической химии «метаболизмом вредных веществ», а продукты превращения – метаболитами.
Более подробно абиотические и биотические превращения будут рассмотрены в разделах «Химия атмосферы», «Химия гидросферы» и «Химия почвы».
Важнейшие виды абиотических превращений и среды, в которых они осуществляются, представлены в таблице 5.
Таблица 5 – Важнейшие виды абиотических превращений
в различных природных средах
| Абиотические (химические) превращения | Среда | ||
| воздух | вода | почва | |
| Окислительно-восстановительные реакции | + | + | + |
| Фотохимические реакции | + | + | – |
| Гидролиз | – | + | + |
Любые превращения – абиотические (химические) или биотические (биохимические) могут быть рассмотрены с точки зрения химической термодинамики и с точки зрения химической кинетики.
Химическая термодинамика на основе сведений об изменении термодинамических функций позволяет:
Для реакции N2 + O2 = 2NO вычислите температуру, выше которой процесс протекает самопроизвольно. Определите содержание NO в равновесной смеси и равновесный выход NO при температурах 298К, 2500К и равновесной температуре, если исходная смесь – воздух.
Воспользуемся уравнением изотермы Вант-Гоффа для стандартных условий с целью вычисления константы равновесия Ка.
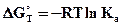 , отсюда
, отсюда 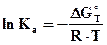
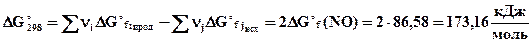
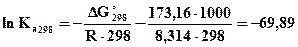
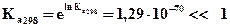 , 4,44 ·10-31
, 4,44 ·10-31
следовательно, процесс протекает самопроизвольно в обратном направлении.
В состоянии равновесия 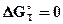 и Ka = 1.
и Ka = 1.
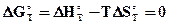 , отсюда
, отсюда 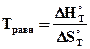
Считаем, что 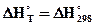 и
и 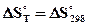 , тогда
, тогда 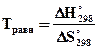 .
.
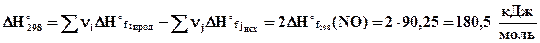
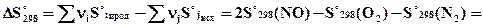
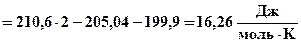
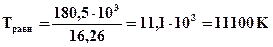
Процесс образования NO из азота и кислорода будет протекать самопроизвольно при T > 11100 K. При этой температуре Ka = 1.
При низких давлениях газы можно считать идеальными, и Ka ≈ Kp.
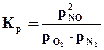
pNO = P·NNO; pO2 = P·NO2; pN2 = P·NN2;
Содержание N2, O2, NO в системе и их мольные доли равны:
N2 O2 NO
νо, моль 0,79 0,21 0
νравн, моль 0,79 – х 0,21 – х 2х
N 0,79 – х 0,21 – х 2х*
* 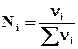 ; Σνi = 0,79 – х + 0,21 – х + 2х = 1
; Σνi = 0,79 – х + 0,21 – х + 2х = 1
T = 298K; 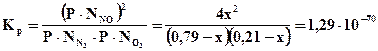
4х2 = (0,79– х)(0,21 – х)·1,29·10-70
4х2 ≈ 0 Þ х ≈ 0 Þ ηNO ≈ 0
T = 2500K; 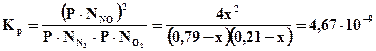
4х2 = (0,79– х)(0,21 – х)·4,67·10-9
4х2 = 1,659·10-10 – х·4,67·10-9 + х2·4,67·10-9
4х2 + х·4,67·10-9 – 1,659·10-10 = 0
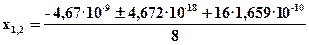
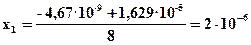
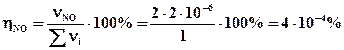
T = 11100K; 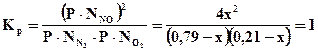
4х2 = (0,79– х)(0,21 – х)
3х2 + х –0,1659 = 0
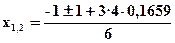
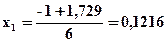
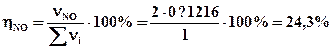
Ответ: Травн = 11100K; η298(NO) = 0; η2500(NO) = 4·10-4%; η11100(NO) = 24,3%.
Химическая кинетика позволяет с помощью кинетических уравнений:
 2014-01-31
2014-01-31 927
927








