Для описания процессов взаимодействия между твердыми веществами и природными водами в настоящее время широко используются методы равновесной термодинамики. В общем виде такое взаимодействие можно представить уравнением:
аА + вВ 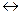 сС + dD.
сС + dD.
Термодинамическая константа этого процесса определяется выражением:
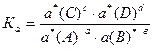 ,
,
где а*i – равновесные активности реагентов.
Численное значение Ка определяют по термодинамическим данным (85).
Значение константы равновесия при температуре, отличающейся от 298 К можно вычислить по уравнению изобары химической реакции в интегральной форме:
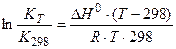 (86).
(86).
При этом допускаем, что тепловой эффект процесса растворения 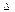 Н не зависит от температуры.
Н не зависит от температуры.
Важными характеристиками природных вод и твердых веществ при рассмотрении процессов растворимости являются часто используемые в зарубежной литературе показатели агрессивности и неустойчивости.
Показатель агрессивности природных вод характеризует способность данной воды перевести твердое вещество в раствор.
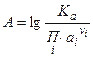 , где
, где 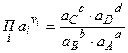 (87)
(87)
В значение Ка входят равновесное активности, в значение 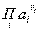 - активности реагентов, содержащихся в данной воде.
- активности реагентов, содержащихся в данной воде.
Показатель агрессивности часто используют для сравнения растворяющей способности природных вод. Чем больше А, тем в большей степени система неравновесна и тем более интенсивно протекает процесс растворения данного вещества.
Показатель неустойчивости характеризует степень удаленности системы от состояния равновесия. Этот показатель удобно использовать при сравнении устойчивости различных твердых веществ по отношению к одной и той же природной воде. Чем больше значение показателя неустойчивости, тем менее устойчиво данное вещество.
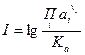 (88)
(88)
Т.е. показатель неустойчивости численно равен показателю агрессивности, взятому с обратным знаком
I = -А
Достаточно часто в природных условиях растворяется чистое твердое вещество (а = 1). В этом случае в водном растворе содержатся только ионы, на которые оно диссоциирует, и молекулы Н2О, и описание процесса упрощается. Уравнение процесса растворения в этом случае:
АаВв→аАв+ + вВа-
Ка = 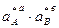 (89)
(89)
Для определения процесса растворения или осаждения в этом случае удобно использовать показатель степени неравновесности:
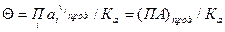 , (90)
, (90)
где Θ – степень неравновесности, 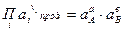 - произведение активности ионов в растворе (ПА)прод.
- произведение активности ионов в растворе (ПА)прод.
Степень неравновесности характеризует ненасыщенность (Θ<1, идет процесс растворения) или пересыщенность (Θ>1, идет процесс осаждения) раствора. В случае, если Θ=1, в системе наблюдается равновесие между твердой и жидкой фазами.
Активности реагентов связаны с их концентрациями:
аi = γi ∙ сi, (91)
где γi – коэффициент активности i-го компонента раствора.
В бесконечно разбавленных растворах γi→1 и аi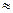 сi. Поэтому для оценки концентрации примесей в растворах часто используют произведение растворимости, которое для процесса (89) будет иметь вид:
сi. Поэтому для оценки концентрации примесей в растворах часто используют произведение растворимости, которое для процесса (89) будет иметь вид:
ПР = 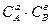 , (92)
, (92)
где СА и СВ – концентрации ионов в растворе, моль/л.
Произведение растворимости и Ка связаны между собой:
ПР = 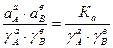 , (93)
, (93)
где γА и γВ – коэффициенты активности соответствующих ионов.
Значения коэффициентов активности ионов можно рассчитать по уравнению Дебая-Хюккеля:

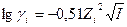 , если I<0,01 (94) или
, если I<0,01 (94) или
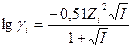 , если 0,01<I<0,1 (95)
, если 0,01<I<0,1 (95)
I – ионная сила раствора, которая равна
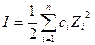 , (96)
, (96)
где сi – концентрации ионов, присутствующих в растворе; Zi – заряды соответствующих ионов.
Уравнения (94) и (95) приведены для водных растворов при Т=298 К.
 2014-01-31
2014-01-31 973
973








