Одной из важных характеристик природных вод во многом определяющих возможности их использования человеком, является жесткость воды. Жесткостью воды называется свойство воды, обусловленное содержанием в ней ионов Са2+ и Mg2+. Единицей жесткости в нашей стране является моль (жесткости) на 1 м3 – моль/м3 или мэкв/л.
1 мэкв/л соответствует содержанию в воде 20,04 мг/л ионов Са2+ или 12,16 мг/л Mg2+. Величину жесткости определяют по уравнению:
Ж = 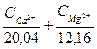 , (97)
, (97)
где Ж – жесткость воды, мэкв/л; 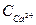 и
и 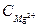 - концентрации ионов кальция и магния в мг/г; 20,04 мг/экв – миллиэквивалент Са2+; 12,16 мг/экв – миллиэквивалент Mg2+.
- концентрации ионов кальция и магния в мг/г; 20,04 мг/экв – миллиэквивалент Са2+; 12,16 мг/экв – миллиэквивалент Mg2+.
Определяемую по уравнению (96) жесткость называют общей жесткостью воды.
Различают карбонатную, некарбонатную, устраняемую (временную) и неустраняемую (постоянную) жесткость воды.
Под карбонатной жесткостью понимают концентрацию ионов Са2+ и Mg2+, связанных с карбонат- и гидрокарбонат-ионами. Поэтому численное значение карбонатной жесткости равно сумме концентраций СО32- и НСО3-, выраженных в мэкв/л. Если эта величина больше общей жесткости, т. е. СО32- и НСО3- связаны с другими катионами, то значение карбонатной жесткости принимается равным значению общей жесткости воды.
Некарбонатная жесткость воды определяется как разность значений общей и карбонатной жесткости.
Устраняемая (временная) жесткость представляет собой часть карбонатной жесткости, которая удаляется при кипячении воды. Устраняемую жесткость определяют экспериментально.
 2014-01-31
2014-01-31 1195
1195
