В процессе химических реакций действуют две тенденции:
1. 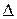 Н
Н  min (энтальпийный фактор);
min (энтальпийный фактор);
2. 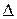 S
S  max (энтропийный фактор).
max (энтропийный фактор).
Оба эти фактора действуют во взаимно-противоположных направлениях и течение реакции определяется тем из них, который преобладает в данном конкретном случае. Изменение энтальпии и энтропии при химической реакции учитывает энергия Гиббса ∆G (кДж):
∆G0х.р. = ∆Н0х.р – Т∆S0х.р. ,
где Т – абсолютная температура, ∆S0х.р. – стандартное изменение энтропии;
∆Н0х.р – стандартное изменение энтальпии.
Величина и знак 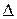 G определяют возможность самопроизвольного протекания химической реакции и ее направление. При постоянной температуре и давлении реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса.
G определяют возможность самопроизвольного протекания химической реакции и ее направление. При постоянной температуре и давлении реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса.
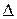 G < 0 - реакция идет самопроизвольно в прямом направлении;
G < 0 - реакция идет самопроизвольно в прямом направлении;
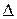 G > 0 - при данных условиях реакция в прямом направлении не идет;
G > 0 - при данных условиях реакция в прямом направлении не идет;
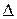 G = 0 - реакция обратима (химическое равновесие).
G = 0 - реакция обратима (химическое равновесие).
Изменение ∆Gх.р не зависит от пути процесса и может быть рассчитано по следствию из закона Гесса: изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ.
|
|
|
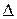 G0хр = Σ∆ f G0продуктов реакции - Σ∆ f G0исходных веществ
G0хр = Σ∆ f G0продуктов реакции - Σ∆ f G0исходных веществ
Например, стандартная энергия Гиббса реакции аА + вВ = сС + dD
∆G0х.р. = (с∆ f G0С + d∆ f G0D) – (a∆ f G0A + b∆ f G0B),
где ∆ f G0– стандартная энергия Гиббса образования вещества, кДж/моль, (справочная величина). Энергия Гиббса образования простых веществ равна нулю.
 2014-01-31
2014-01-31 821
821








