Азотофиксация
Железо и его соединения
Фосфор
Превращения Р сводится в основном к двум процессам:
1)минерализации органических соединений Р
2)перевода фосфорнокислых солей из менее растворимых в более растворимые формы.
Минерализацию осуществляют почвенные бактерии, грибы, актин.
Гидролитическим путем от орг.соединений отщепляется фосфорная кислота. Р переходит в неорганическую форму. Фосфорная кислота быстро связывается основаниями почвы и приходит в труднорастворимые и мало пригодные для питания растений соли Са, Mg, Fe.
Растворение фосфатов в почве происходит в результате разнообразных биохимических процессов, сопровождающихся образованием кислот. Фосфаты растворяются азотной, серной кислотами, образуют в процессах
Нитрификации, а также кислыми выделениями растений.
Вас.megateribm активно разрушает фосфорорганические соединения и освобождает легко доступные соли фосфорной кислоты.
Планируется их промышленное использование.
Широко распространено в природе и одбуславливая разнообразие цветов и оттенков горных пород, глин и песков; вместе с тем Fе является одим из важнейших элементов органической жизни.
Перевод закислых солей Fе в окислые осуществляется железобактериями.
Хемоссинтезирерющие, нити.
Гидрат окиси железа отлагается у них в слизистых влгалищах. Они образуют окисления руд Leptothrix, Poladothrix.
В земной коре 0,04% азота. В воздухе 78% или 4х1015 тонн.
Ежегодно растения выносят 10 млн тонн азота; за счёт минеральных удобрений 4 млн тонн выносится и органические 2,5 млн, 4-5 млн тонн – дефицит.
1. Опытное обоснование молекулярно-кинетической теории
Настоящая часть курса посвящена молекулярной физике и основам теории теплоты – термодинамике. Молекулярная физика изучает те свойства вещества, которые обусловлены его молекулярным строением. В ней рассматриваются превращения вещества, связанные с изменением энергии его молекул, изменения агрегатного состояния тел и т. д.
При этом мы исключаем из рассмотрения те явления, которые связаны с изменением состава, перестройкой молекул, что является в значительной степени областью химии.
Выделенный таким образом круг вопросов охватывается единым методом рассмотрения, единой теорией, носящей название молекулярно-кинетической теории вещества. Тепловые явления будут трактоваться также с точки зрения молекулярно-кинетической теории вещества.
Перечислим коротко те явления, которые подтверждают правильность исходных идей молекулярно-кинетической теории.
1. Высокая сжимаемость газов свидетельствует о наличии больших расстояний между молекулами газа.
2. Стремление газа занять любой, сколь угодно большой, предоставленный в его распоряжение объем свидетельствует о том, что молекулы газа движутся независимо друг от друга.
3. Взаимное проникновение соприкасающихся газов – диффузия газов – показывает, что молекулы одного газа движутся в «пустотах» между молекулами второго газа.
4. Смешение жидкостей, растворение твердых тел в жидкостях также объясняются перемешиванием молекул разных сортов. При этом существенно, что объем смеси может отличаться от суммы объемов несмешанных веществ, что свидетельствует о различной компактности молекулярных систем. К этому же кругу вопросов относятся и явления испарения жидких и твердых тел.
5. Давление газа на стенки сосуда, в котором он заключен (или на поверхность тела, введенного в газ), объясняется ударами молекул газа. Повышение давления при увеличении плотности газа (при его сжатии) объясняется увеличением относительного числа молекул, бомбардирующих поверхности, ограничивающие газ. Точно так же увеличение давления с повышением температуры объясняется увеличением скорости молекул, что приводит к учащению их столкновений со стенками сосуда и к увеличению «силы» удара.
6. Прихотливое движение мельчайших твердых частиц, взвешенных в жидкости или газе, – броуновское движение – объясняется неуравновешенностью ударов, испытываемых броуновской частицей со стороны молекул жидкости (газа). В силу малости размеров и масс молекул их толчки могут привести в движение лишь очень легкие, броуновские, частицы.
Однако все эти качественные соображения не дают еще возможности судить о том, одинаковы ли молекулы вещества по массам и другим свойствам или же они представляют собой «осколки» веществ произвольных размеров. Ответ на этот вопрос был получен впервые с помощью химических исследований.
7. Согласно закону кратных отношений Дальтона при соединении различных элементов количества соединяющихся веществ не произвольны, но могут находиться лишь в простых отношениях. Закон кратных отношений легко объяснить, если предположить, что мельчайшие частицы химически простых веществ – атомы – одинаковы по массе и свойствам.
8. Опыт показывает, что в равных объемах газа при одинаковых давлениях и температурах находится одинаковое число молекул. Многочисленные опыты позволили Авогадро сформулировать закон:
В равных объемах газа, при равных температурах и давлениях содержится равное число молекул газа.
При изложении основных идей современной молекулярно-кинетической теории вещества и общих закономерностей тепловых явлений будем исходить из трех основных положений.
1. Все тела состоят из мельчайших частиц – атомов и молекул.
2. Атомы и молекулы находятся в состоянии непрерывного движения. Движение это является вечным, не прекращаясь ни при каких условиях.
3. Молекулы различных веществ по-разному взаимодействуют между собой. Взаимодействие это существенно зависит от типа молекул и от расстояний между ними. В частности, зависимостью молекулярных сил от межмолекулярных расстояний объясняется качественное различие разных агрегатных состояний тел (газ, жидкость, твердое тело).
Различают два вида движения: движение тела как целого и хаотическое тепловое движение молекул тела, происходящее независимо от того, движется ли тело как целое или нет.
Тепловое движение будем характеризовать средней кинетической энергией одной молекулы e кин, а взаимодействие между молекулами – потенциальной энергией взаимодействия u пот.
В твердых телах молекулы расположены близко друг к другу, и поэтому свойства этих тел существенно зависят от величины u пот.
Плотность газов при обычных давлениях и температурах в тысячи раз меньше плотности твердых и жидких тел. Это свидетельствует о том, что в газе средние расстояния между молекулами примерно в 10 раз больше, чем в конденсированных телах. При таких расстояниях между молекулами можно ожидать, что их взаимодействие будет играть очень малую роль, т.е. средняя кинетическая энергия молекул e кин будет значительно больше абсолютного значения средней потенциальной энергии | u пот|.
При достаточно больших расстояниях между молекулами газа, т.е. в случае достаточно разреженных газов, энергией межмолекулярного взаимодействия u пот можно вообще пренебрегать., т.е. физические свойства достаточно разреженных газов не должны зависеть от их химической природы. Конечно, здесь имеются в виду те свойства, которые не зависят от масс молекул, различных для разных веществ.
Движение каждой молекулы тела может быть описано законами классической механики. Однако число молекул во всяком теле чрезвычайно велико, а направление и величина скорости каждой из них в данный момент случайны. Свойства молекул, образующих тело, подчиняются статическим закономерностям и могут быть изучены с помощью статистического метода.
Хотя скорость и направление движения каждой молекулы в любой момент времени случайны, в совокупном движении огромного числа молекул проявляются определенные закономерности. Так, большинство молекул обладает величинами скорости, энергии, импульса и других характеристик движения, близкими к некоторым вполне определенным при данных условиях величинам (наиболее вероятным).
С помощью теории вероятностей вычисляются средние значения физических величин, характеризующие движение всей совокупности молекул (средние скорости молекул, среднее значение энергии молекулы и т. д.). Статистический метод широко используется в форме классической и квантовой статистик и позволяет исследовать весьма разнообразный круг вопросом молекулярной физики.
Наряду со статическим методом для изучения физических явлений применяется термодинамический метод.
Термодинамика изучает условия превращения энергии из одного вида в другой и характеризует эти превращения энергии с количественной стороны.
Совокупность рассматриваемых тел, обменивающихся энергией как между собой, так и с другими (внешними) телами, называется термодинамической системой. В основе термодинамического метода исследования лежит понятие о состоянии термодинамической системы. Состояние системы определяется совокупностью значений этих величин, характеризующих физические свойства системы и называемых ее термодинамическими параметрами. В качестве примера термодинамических параметров тел можно назвать их температуру, плотность, теплоемкость, удельное электрическое сопротивление и т. д. Два состояния системы считаются разными, если для них неодинаковы значения хотя бы одного из термодинамических параметров.
Состояние термодинамической системы называется стационарным,если значения всех термодинамических параметров системы не изменяются во времени. Стационарное состояние системы называется равновесным,если его неизменность во времени не обусловлена протеканием каких-либо процессов во внешних по отношению к системе телах.
Исследования показывают, что для каждого тела термодинамические параметры взаимно связаны. Например, удельное электрическое сопротивление, вязкость и многие другие свойства тела зависят от их температуры. Поэтому оказывается, что равновесное состояние термодинамической системы однозначно определяется заданием значений ограниченного числа ее термодинамических параметров, называемых параметрами состояния.
Важнейшими параметрами состояния химически однородной системы являются: плотность ρ, давление р и температура T '. Между основными параметрами состояния существует связь, наливаемая уравнением состояния:
f (р, r, T) = 0.
Зная уравнение состояния вещества и используя законы термодинамики, можно изучать свойства веществ в различных агрегатных состояниях.
Между статистическим и термодинамическим методами существуют глубокие связи. Современная физика развивается на базе тесного сочетания обоих методов.
1.1. ОПЫТНЫЕ ЗАКОНЫ ИДЕАЛЬНЫХ ГАЗОВ
Рассмотрим некоторые свойства идеальных газов.
Идеальнымназывается газ, между молекулами которого отсутствуют силы взаимного притяжения, при соударениях молекулы газа ведут себя как абсолютно упругие шарики исчезающе малых размеров.
Р.Бойль (1662 г.) и Э.Мариотт (1676 г.) экспериментально установили, что произведение давления газа на занимаемый им объем при постоянной температуре есть величина постоянная:
pV = const при m = const и T = const.
Гей-Люссак (1802 г.) нашел, что объем газа пропорционален его абсолютной температуре (при постоянных m и р), т.е.
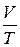 = const при m = const и р = const,
= const при m = const и р = const,
давление также пропорционально абсолютной температуре (при постоянных m и V), т.е.
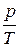 = const при m = const и p = const.
= const при m = const и p = const.
Эти законы справедливы для достаточно разреженных газов, т.е. для газов, в которых средние расстояния между молекулами значительно превышают диаметры молекул.
Рассмотрим следующее соотношение (уравнение Клапейрона):
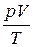 = const при m = const.
= const при m = const.
Легко видеть, что оно объединяет законы Бойля-Мариотта и Гей-Люссака.
С помощью уравнения Клапейрона можно рассчитывать процессы, при которых меняются все три величины р, V, Т одновременно, а не только какая-либо их пара.
В дальнейшем мы будем это уравнение, связывающее основные величины, характеризующие газ, – р, V и Т, – называть уравнением состояния.
В 1874 г. Д.И.Менделеев получил уравнение состояния для произвольной массы любого газа называемое уравнением Менделеева–Клапейрона.
pV = n RT = 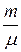 RT,
RT,
где R – универсальная газовая постоянная.
2. Молекулярно-кинетическая теория газов
2.1. Скорости молекул газа
Молекулы газа в каждый момент времени отличаются друг от друга своим местоположением и характером своего движения. Каждая молекула будет двигаться со скоростью 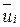 , отличающейся от скоростей других молекул по величине и по направлению, при этом различные значения скоростей не равновероятны.
, отличающейся от скоростей других молекул по величине и по направлению, при этом различные значения скоростей не равновероятны.
В качестве характеристики движения всей совокупности молекул, введем понятия средней квадратичной скорости и средней скорости молекул.
Кинетическая энергия поступательного движения молекул идеального газа Е пост есть сумма кинетических энергий поступательного движения ei пост всех его N молекул:
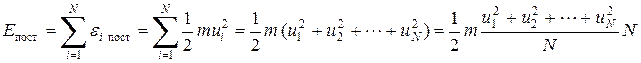
Введя понятие средней квадратичной скорости
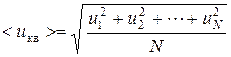
можно записать выражения для кинетической энергии поступательного движения всех молекул
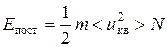
и для средней кинетической энергии поступательного движения одной молекулы
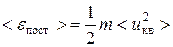
Средняя арифметическая скорость молекул газа определяется из соотношения
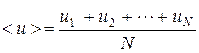
1.3. Основное уравнение кинетической теории газов
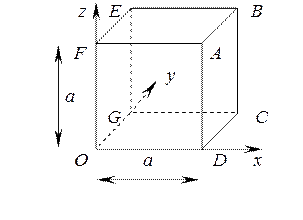 Определим давление, возникающее в результате удара молекул о стенки сосуда. Рассмотрим произвольную молекулу массой mi, имеющую скорость
Определим давление, возникающее в результате удара молекул о стенки сосуда. Рассмотрим произвольную молекулу массой mi, имеющую скорость  , находящуюся в кубическом сосуде с длиной ребра а и объемом V = a 3
, находящуюся в кубическом сосуде с длиной ребра а и объемом V = a 3
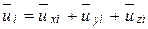
При абсолютно упругом ударе о грань куба ABCD изменение импульса молекулы
D(miui) = – 2 miuxi ,
при этом импульс силы, действующий на стенку сосуда
fi Dti = 2 miuxi,
а сила, действующая на стенку fi =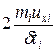 ,
,
где dti – продолжительность удара.
Отскочив от грани ABCD молекула полетит к противоположной грани, отскочив от нее вновь вернется к грани ABCD через время D ti. Средний импульс силы < fi> D ti, действующий на грань ABCD за время D ti
< fi> D ti = fi dti = 2 miuxi.
Между двумя последовательными соударениями молекула пройдет путь 2 а со скоростью uxi за время
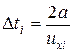
Тогда средняя сила < fi>, действующая на грань куба со стороны одной молекулы
< fi> = 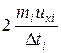 =
= 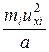 ,
,
а со стороны всех молекул
< Fx > = 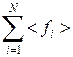 =
= 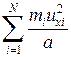 =
= 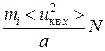 ,
,
где < u кв x > – проекция средней квадратичной скорости на ось х, N – число молекул в объеме куба.
Давление, оказываемое газом на стенку ABCD сосуда
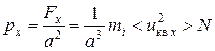 ,
,
аналогично для граней ABEF и EBCG
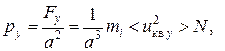
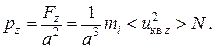
Движение молекул газа хаотично, следовательно
р = рx = рy = рz
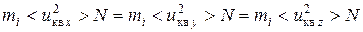 .
.
С другой стороны
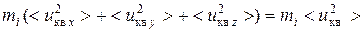 ,
,
следовательно
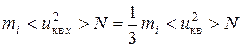 ,
,
тогда 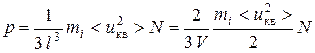 .
.
Учитывая, что средняя кинетическая энергия поступательного движения молекулы
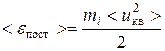
и концентрация молекул 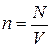 ,
,
получим 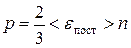 .
.
Данное выражение является основным уравнением кинетической теории газов.
Из уравнения Менделеева–Клапейрона
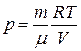
Тогда 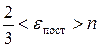
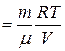 ,
,
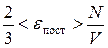
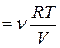
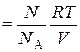 .
.
Тогда средняя энергия поступательного движения одной молекулы
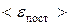
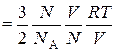
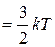
Подставив полученное выражение в основное уравнение кинетической теории газов, получим
p = n k T.
Распределение энергии по степеням свободы
Числом степеней свободы тела называется наименьшее число независимых координат, необходимых для определения положения тела в пространстве.
Одноатомная молекула (ее можно рассматривать как материальную точку) в пространстве обладает тремя степенями свободы (i = 3), т.к. ее положение задается тремя независимыми координатами x, y, z. Тогда кинетическая энергия поступательного движения молекул одноатомного газа
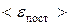
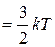
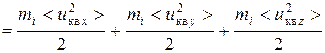 .
.
При равной вероятности всех направлений скорости по координатным осям
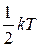
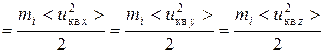 ,
,
т.е. средняя энергия теплового движения одноатомных молекул равномерно распределяется между тремя степенями свободы их поступательного движения, и на каждую степень свободы приходится энергия равная 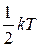 .
.
Для двухатомных молекул наряду с тремя поступательными степенями свододы возможны вращательные движения молекулы вокруг двух осей, проходящих через центр ее масс и перпендикуляных к оси самой молекулы.
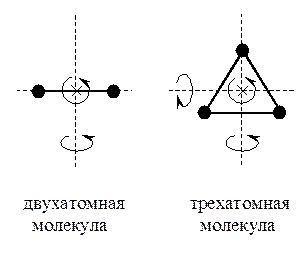 Кинетическая энергия вращательного движения молекулы относительно одной из осей равна
Кинетическая энергия вращательного движения молекулы относительно одной из осей равна
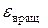
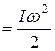 .
.
Момент инерции I молекулы относительно собственной оси молекулы равен 0. Вращение молекулы относительно ее собственной оси не изменяет ее положения в пространстве. Таким образом, двухатомные молекулы обладают пятью (тремя поступательными и двумя вращательными) степенями свободы (i = 5), на каждую из которых, в соответствии с законом равномерного распределения энергии по степеням свободы, приходится энергия равная 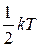 [1].
[1].
Для трех и более атомных молекул наряду с тремя поступательными степенями свободы возможны вращательные движения молекулы вокруг трех осей, проходящих через центр ее масс, следовательно, трех и более атомные молекулы обладают шестью (тремя поступательными и тремя вращательными) степенями свободы (i = 6)[2],. на каждую из которых приходится энергия равная 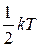 .
.
Если отдельные атомы в молекуле могут еще и смещаться (колебаться) относительно ее центра масс, то необходимо ввести дополнительно степени свободы колебательного движения[3].
Таким образом, если молекула обладает i степенями свободы, то ее средняя кинетическая энергия
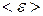
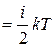 .
.
1.4. Средняя длина свободного пробега молекул
 Молекулы газа движутся хаотично, их траектории представляют собой ломаные линии из-за непрерывных соударений друг с другом. Путь, пройденный молекулами между двумя последовательными соударениями, называется длиной свободного пробега l. Длина свободного пробега меняется от соударения к соударению, поэтому вводится понятие средней длины свободного пробега < l >, как среднего пути, пройденного молекулой между двумя последовательными соударениями.
Молекулы газа движутся хаотично, их траектории представляют собой ломаные линии из-за непрерывных соударений друг с другом. Путь, пройденный молекулами между двумя последовательными соударениями, называется длиной свободного пробега l. Длина свободного пробега меняется от соударения к соударению, поэтому вводится понятие средней длины свободного пробега < l >, как среднего пути, пройденного молекулой между двумя последовательными соударениями.
Для нахождения средней длины свободного пробега необходимо средний путь < L >, пройденный молекулой за некоторый промежуток времени t, разделить на среднее число соударений < Z > за это же время
< l > = 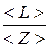 или < l > =
или < l > = 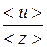 ,
,
где < u > – средняя арифметическая скорость молекулы, < z > – среднее число соударений в единицу времени.
При движении со скоростью < u отн> молекула будет сталкиваться со всеми молекулами газа, центры которых отстоят от траектории ее движения на расстояниях меньших или равных эффективному диаметру молекулы d, т.е. со всеми молекулами, центры которых лежат внутри ломанного цилиндра длиной < u отн> t и радиусом основания d.
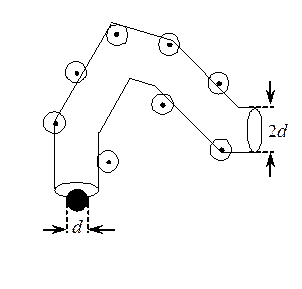 Среднее число соударений молекулы в единицу времени
Среднее число соударений молекулы в единицу времени
< z > = p d 2 n < u отн >,
где n – концентрация молекул, < u отн> – средняя скорость движения молекул относительно друг друга (средняя относительная скорость).
Так как средняя относительная скорость < u отн> связана со средней арифметической скоростью движения < u > соотношением
< u отн> = 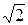 < u >,
< u >,
то < z > = 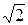 p d 2 n < u >
p d 2 n < u >
и < l > = 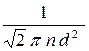 .
.
Выразив концентрацию n молекул из уравнения p = n k T, получим
< l > = 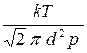 .
.
1.5. Явления переноса
1.5.1. Явления переноса в газах
Хаотичность теплового движения молекул приводит к постоянному перемешиванию частиц, изменению их импульсов и энергий. Если в газе существует пространственная неоднородность плотности, температуры или скорости упорядоченного перемещения отдельных слоев газа, то хаотическое движение молекул со временем выравнивает эти неоднородности, т.е. в процессе хаотического теплового движения происходит перенос молекулами своих физических величин: массы, энергии или импульса. Механизм этих явлений одинаков и они носят название явлений переноса.
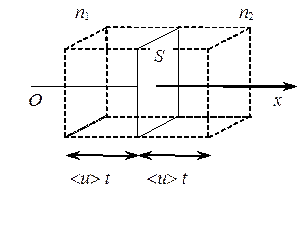 Исходя из представлений молекулярно-кинетической теории газов, получим общее уравнение для явлений переноса.
Исходя из представлений молекулярно-кинетической теории газов, получим общее уравнение для явлений переноса.
Рассмотрим некоторую площадку S, расположенную в газе.
Так как молекулы газа движутся хаотично, то в направлении оси Ох будет двигаться только 1/6 часть всех молекул.
Двигаясь со средней арифметической скоростью < u > через площадку S пройдут все молекулы, находящиеся в объемах < u > t S слева (N 1) и справа (N 2) от площадки
N 1 = 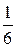 n 1 < u > S t, N 2 =
n 1 < u > S t, N 2 = 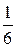 n 2 < u > S t,
n 2 < u > S t,
где n 1, n 2 – концентрация молекул слева и справа от площадки S.
Эти молекулы, перемещаясь через площадку S, переносят некоторую физическую величину j (массу, энергию, импульс).
Количество физической величины, переносимое молекулами в направлении оси Ox через площадку S за время t,
N 1 j = 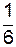 (n 1 j) < u > S t.
(n 1 j) < u > S t.
Количество физической величины, переносимое в обратном направлении, через площадку S за время t,
N 2 j = 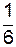 (n 2 j) < u > S t.
(n 2 j) < u > S t.
Если рассматриваемый газ неоднороден по своим физическим характеристикам, то их перенос D N j через площадку S за время t равен
D N j = 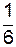 (n 1 j – n 2 j) < u > S t.
(n 1 j – n 2 j) < u > S t.
Перенос количества физической величины nj осуществляется при соударении молекул, поэтому значение физической величины j сохраняется неизменным на расстоянии < l > влево и вправо от площадки S. Поскольку < l > мало, то разность (n 1 j – n 2 j) можно представить в виде
n 1 j – n 2 j = – 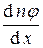 2 < l >.
2 < l >.
Тогда D N j = – 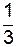 (
(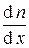 j) < l > < u > S t.
j) < l > < u > S t.
Знак “–” показывает, что перенос физической величины происходит в направлении ее уменьшения.
Полученная формула называется уравнением переноса. На его основе рассмотрим явление переноса: диффузию, теплопроводность и внутреннее трение (вязкость) газов.
1.5.1.1. Диффузия газов
Диффузия – явление, заключающееся в самопроизвольном взаимном проникновении и перемешивании частиц газа. Диффузия возникает вследствие неодинаковой плотности в различных частях объема газа или различия в концентрациях в разных частях объема смеси газов. Диффузия заключается в переносе массы газа из области с большей концентрацией данного газа в область с меньшей концентрацией.
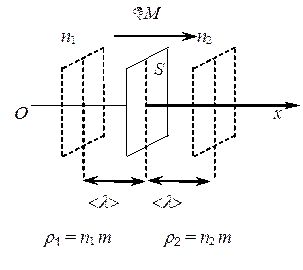 Рассмотрим некоторый объем газа с неоднородностью плотности, т.е.
Рассмотрим некоторый объем газа с неоднородностью плотности, т.е.
r 1 > r 2, при этом r 1 = n 1 m, r 2 = n 2 m.
Переносимой физической величиной j является масса m молекулы. Тогда уравнение переноса примет вид:
D N m = D M = – 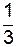
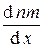 < l >< u > S t =
< l >< u > S t =
= – 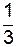 < l > < u >
< l > < u > 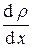 S t,
S t,
где D M – масса газа, переносимая при диффузии за время t, через площадку S, перпендикулярно направлению убывания плотности r.
Обозначив 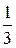 < l > < u > = D,
< l > < u > = D,
получим D M = – D 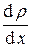 S t.
S t.
Полученная формула называется уравнением диффузии или законом Фика.
Коэффициент диффузии D зависит от сорта газа и его состояния (p, T).
1.5.1.2. Теплопроводность газов
Теплопроводность – явление выравнивания температур различных областей газа. Теплопроводность заключается в переносе энергии молекулами из более нагретых областей к более холодным.
Рассмотрим некоторый объем газа с неоднородностью в отношении температуры (T 1 > T 2).
Переносимой физической величиной является энергия молекул e. Так как наблюдается неоднородность по температуре, т.е. T 1 > T 2 , а
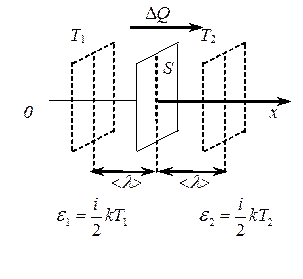 e 1 =
e 1 = 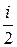 kT 1, e 2 =
kT 1, e 2 = 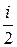 kT 2, то e 1 > e 2,
kT 2, то e 1 > e 2,
где i – число степеней свободы молекулы газа.
Уравнение переноса переноса для теплопроводности можно записать:
D N 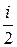 kT = D Q,
kT = D Q,
D Q = – 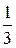 (
(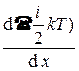 ) < l >< u > S t = –
) < l >< u > S t = – 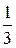 < l > < u > n
< l > < u > n 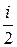 k
k 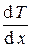 ,
,
где D Q – количество теплоты, переносимое за счет теплопроводности за время t через площадку S, в направлении убывания температуры Т.
Обозначив 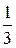 < l > < u > n
< l > < u > n 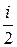 k = c,
k = c,
получим D Q = – c 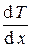 S t.
S t.
Полученная формула называется уравнением теплопроводности или законом Фурье.
Коэффициент теплопроводности c не зависит от давления, если средняя длина свободного пробега меньше размеров сосуда.
1.5.1.3. Внутреннее трение (вязкость) газов
Внутреннее трение связано с взаимодействием между слоями газа, перемещающимися параллельно друг другу с разными по величине скоростями. Причиной внутреннего трения является наложение упорядоченного движения слоев газа с различными скоростями на хаотическое тепловое движение молекул со средней скоростью < u >, величина которой зависит от температуры.
Благодаря тепловому движению, молекулы переходят из слоя, движущегося со скоростью 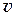 1 , в слой, движущийся со скоростью
1 , в слой, движущийся со скоростью  2 и наоборот. При этом молекулы переносят импульсы своего упорядоченного движения.
2 и наоборот. При этом молекулы переносят импульсы своего упорядоченного движения.
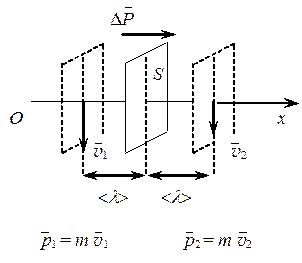
|
Рассмотрим площадку S, расположенную между двумя слоями газа, движущегося соответственно со скоростями  1 и
1 и  2 (
2 (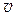 1 >
1 >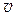 2), т.е. наблюдается неоднородность в отношении импульса упорядоченного движения молекул.
2), т.е. наблюдается неоднородность в отношении импульса упорядоченного движения молекул.
Так как 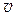 1 >
1 > 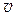 2, то m
2, то m 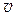 1 > m
1 > m 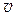 2.
2.
Уравнение переноса примет вид
D Р = D N m 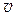 ,
,
D Р = – 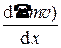 < l >< u > S t = –
< l >< u > S t = – 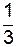 < l > < u > n m
< l > < u > n m 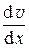 S t,
S t,
где D Р – изменение импульса слоя газа, ограниченного площадкой S, за время t.
Изменение импульса слоя газа равно импульсу силы трения, действующему в направлении движения газа (параллельному площадке S), т.е. D Р = F тр t.
Тогда f тр = 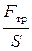 = –
= – 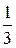 < l > < u > n m
< l > < u > n m 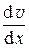 = –
= – 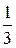 < l > < u > r
< l > < u > r 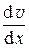 ,
,
где f тр – сила трения, действующая на единицу площади, r – плотность газа.
Обозначив 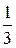 < l > < u > r = h,
< l > < u > r = h,
получим f тр = – h 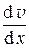 .
.
Полученное уравнение называется уравнением внутреннего трения (вязкости) или законом Ньютона.
Коэффициент внутреннего трения (вязкости) h не зависит от давления, если средняя длина свободного пробега меньше размеров сосуда.
1.5.2. Явление переноса в жидкостях
 Молекулы жидкости расположены, в отличие от молекул газа, близко друг к другу и взаимодействуют друг с другом. Между молекулами располагаются микрополости. Молекула жидкости колеблется около положения равновесия некоторое время t, затем она “перескакивает” на расстояние порядка среднего расстояния < d > между соседними молекулами. Среднее время < t > нахождения молекулы около положения равновесия (время релаксации) зависит от температуры, уменьшаясь с ее увеличением. Средняя скорость перемещения молекул жидкости < v > =
Молекулы жидкости расположены, в отличие от молекул газа, близко друг к другу и взаимодействуют друг с другом. Между молекулами располагаются микрополости. Молекула жидкости колеблется около положения равновесия некоторое время t, затем она “перескакивает” на расстояние порядка среднего расстояния < d > между соседними молекулами. Среднее время < t > нахождения молекулы около положения равновесия (время релаксации) зависит от температуры, уменьшаясь с ее увеличением. Средняя скорость перемещения молекул жидкости < v > = 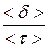 невелика (значительно меньше, чем скорость молекул газа при той же температуре).
невелика (значительно меньше, чем скорость молекул газа при той же температуре).
В жидкостях, как и газах, в случае появления пространственной неоднородности плотности, температуры или скорости упорядоченного движения молекул, возникают явления переноса – диффузия, теплопроводность и внутреннее трение. Явления переноса в жидкостях, как и в газах, обусловлены тепловым движением молекул и подчиняются тем же законам Фика, Фурье и Ньютона.
Особенности строения жидкости и теплового движения их молекул сказываются на значениях коэффициентов переноса и на их зависимости от параметров состояния.
Коэффициент диффузии D жидкостей возрастает с увеличением температуры, что связано с сокращением времени релаксации и некоторым увеличением среднего расстояния < d > между положениями равновесия.
Процесс теплопроводности в жидкостях осуществляется путем взаимодействия колеблющихся молекул. Так как молекулы жидкости расположены близко друг к другу, то коэффициент теплопроводности у них значительно больше, чем у газов.
Механизм внутреннего трения у жидкостей отличен от газов. Молекулы жидкостей большую часть времени находятся около положения равновесия, поэтому масса жидкости увлекает соседние слои, в основном, за счет сил сцепления. Коэффициент внутреннего трения у жидкостей с ростом температуры резко уменьшается. Вязкость жидкости во много раз больше, чем вязкость газа.
2. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ТЕРМОДИНАМИКИ
Величины, характеризующие состояние газа, называются параметрами состояния. К ним относятся давление р, температура Т, объем V.
Внутренняя энергия U системы молекул складывается из энергии хаотического движения молекул (поступательного и вращательного), а также колебательного движения атомов в молекулах, потенциальной энергии, обусловленной взаимодействием молекул. Энергию электронных оболочек атомов и ионов, а также энергию движения и взаимодействия нуклонов в атомных ядрах не включают в понятие внутренней энергии тела, так как эта энергия не изменяется в процессах, не связанных с химическими реакциями и другими превращениями электронных оболочек атомов и ионов, с ядерными реакциями.
Для идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется только кинетической энергией движения всех его молекул.
Средняя энергия движения одной молекулы
< e > = 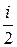 k T,
k T,
где i – число степеней свободы молекул, k – постоянная Больцмана.
Внутренняя энергия идеального газа есть сумма энергий движения всех молекул
U = 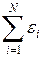 = N < e > = n N A < e > =
= N < e > = n N A < e > = 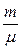 N A < e >,
N A < e >,
где N – число молекул в газе, N A – число Авогадро, n – число молей газа,
m – масса газа, m – молярная масса газа.
Тогда U = 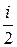
 k N A T =
k N A T = 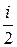
 R T,
R T,
где R – универсальная газовая постоянная.
Изменение внутренней энергии идеального газа
d U = 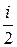
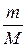 R d T,
R d T,
где d T – изменение температуры газа,
или D U = 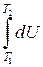 =
= 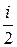
 R D T.
R D T.
Изменить состояние тела можно передавая энергию от одного тела термодинамической системы[4] к другому. Передача энергии может происходить двумя качественно различными способами: путем совершения работы А или путем передачи теплоты Q.
Работа – есть мера изменения механической энергии при силовом воздействии между телами. Совершение работы всегда сопровождается перемещением тела или его макроскопических частей.
Энергия, переданная от одного тела к другому путем теплообмена, называется теплотой, отданной одним телом другому.
Элементарная работа d A, совершающаяся при расширении газа на d V, рассчитывается по формуле
d A = p d V,
а работа, совершающаяся при расширении газа от V 1 до V 2, по формуле
А = 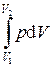 ,
,
где р – давление, которое производится на газ внешними силами (внешнее давление); V 1 , V 2 – начальный и конечный объем газа.
Теплоемкости идеальных газов
Для определения количества теплоты d Q, переданного термодинамической системе для изменения ее температуры, введем понятия теплоемкостей. В зависимости от способа измерения количества вещества в системе подразделяют удельную теплоемкость, молярную теплоемкость и теплоемкость.
Удельной теплоемкостью называется физическая величина с, численно равная теплоте d Q, которую сообщают единице массы однородного тела для повышения его температуры на d T.
c = 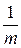
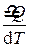 .
.
Молярной теплоемкостью называется физическая величина С, численно равная теплоте d Q, сообщенной одному молю вещества для изменения его температуры на d T.
C = 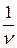
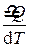 .
.
где n =  – число молей.
– число молей.
Очевидно, что С = m c.
Теплоемкостью тела (системы) называется физическая величина, численно равная теплоте d Q, которую сообщают всему телу (системе) для повышения его температуры на d T,
С = 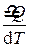 .
.
Tогда С = c m и С = Сn.
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Существование двух способов передачи энергии термодинамической системе позволяет закон сохранения энергии представить в виде
D U = A' + Q,
где D U – изменение внутренней энергии, A' – работа, совершенная над системой внешними силами, Q – переданная системе теплота,
или Q = D U + A,
где А = – A’ – работа, совершаемая самой системой против внешних сил.
Отсюда вытекает следующая формулировка первого начала термодинамики: теплота, переданная системе в процессе изменения ее состояния, расходуется на изменение ее внутренней энергии и на совершение работы против внешних сил. Первое начало термодинамики записывают также для изменения состояния системы, вызванного сообщением ей малой теплоты d Q, совершением ей малой (элементарной) работы d A и приводящего к малому изменению внутренней энергии d U
d Q = d U + d A.
Обратим внимание на различие в записях малых величин (d Q, d U, d A).
Внутренняя энергия является однозначной функцией состояния термодинамической системы, т.е. значение внутренней энергии в каком-либо произвольно выбранном состоянии не зависит от способа перевода ее в это состояние. Изменение внутренней энергии d U представляет собой полный дифференциал. Работа и теплота не являются функциями состояния и поэтому d Q, d A не являются полными дифференциалами.
Применение I начала термодинамики
Рассмотрим применение I начала термодинамики к изопроцессам, а также к адиабатическому процессу идеальных газов.
1. Изохорный процесс (V = const).
Элементарная работа, совершаемая газом
d А = p d V.
Так как V = const, то d А = 0.
Для элементарного количества теплоты d Q из I начала термодинамики
d Q = d U = 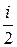
 R d T,
R d T,
или Q = D U = 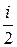
 R D T,
R D T,
т.е. при изохорном процессе вся подводимая к газу теплота затрачивается на увеличение внутренней энергии газа,
Удельная теплоемкость при постоянном объеме
c v = 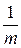
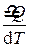 =
= 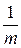
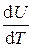 =
= 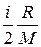 ,
,
C v = 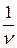
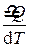 =
= 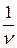
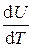 =
= 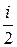 R.
R.
Количество теплоты для изохорного процесса можно представить в виде
d Q = C v n d T = с v m d T = 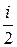
 R d T
R d T
или Q = C v n D T = с v m D T = 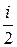
 R D T.
R D T.
2. Изобарный процесс (р = const).
Элементарная работа, совершаемая газом
d А = p d V.
С учетом уравнения Менделеева–Клапейрона
d А = p d V = 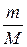 R d T.
R d T.
Работа, совершаемая газом при увеличении объема от V 1 до V 2
А = 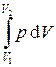 = p (V 2 – V 1) = p D V =
= p (V 2 – V 1) = p D V =  R D T.
R D T.
Первое начало термодинамики можно представить в виде
d Q = c v m d T +  R d T =
R d T = 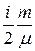 R d T +
R d T +  R d T =
R d T = 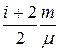 R d T.
R d T.
Q = c v m D T +  R D T =
R D T = 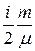 R D T +
R D T +  R D T =
R D T = 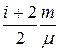 R D T.
R D T.
Удельная теплоемкость при постоянном давлении
c р = 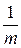
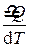 =
= 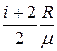 ,
,
C р = 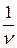
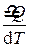 =
= 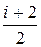 R.
R.
Количество теплоты для изохорного процесса можно представить в виде
d Q = C p n d T = с p m d T = 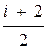
 R d T
R d T
или Q = C p n D T = с p m D T = 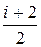
 R D T.
R D T.
3. Изотермический процесс (Т = const)
При изотермическом процессе внутренняя энергия газа, зависящая от температуры, не изменяется, т.е.
d U = 0,
и I начало термодинамики имеет вид
d Q = d A
или Q = A.
Теплота, подводимая к газу при изотермическом процессе, расходуется на совершение работы газом.
Элементарная работа, совершаемая газом
d А = p d V
или А = 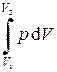 .
.
Учитывая уравнение Менделеева–Клапейрона, получим
d А =  R Т
R Т 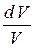 .
.
Работа газа при изотермическом расширении от V 1 до V 2
А = 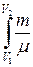 R Т
R Т 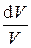 =
=  R Т ln
R Т ln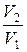 .
.
Количество теплоты для изотермического процесса
Q =  R Т ln
R Т ln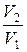 .
.
4. Адиабатический процесс.
Адиабатический процесс – термодинамический процесс, в котором система не обменивается теплотой с окружающей средой, т.е. d Q = 0.
Тогда I начало термодинамики для адиабатического процесса имеет вид
d U + d A = 0,
d A = – d U
или D U + A = 0,
A = – D U.
Газ совершает работу за счет изменения своей внутренней энергии. При совершении работы температура газа изменяется от T 1 до T 2.
Элементарная работа
d A = – d U = – c v m d T = – 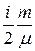 R d Т.
R d Т.
Работа адиабатического расширения газа
A = – D U = –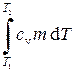 =
= 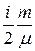 R (Т 1 – Т 2).
R (Т 1 – Т 2).
Учитывая теорему Майера (С р – С v = R) и уравнение Менделеева–Клапейрона, можно получить уравнение адиабатического процесса.
p d V = 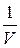
 R Т d V =
R Т d V = 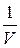
 (С р – С v) Т d V.
(С р – С v) Т d V.
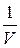
 (С р – С v) Т d V = –
(С р – С v) Т d V = –  С v d T,
С v d T,
 (С р – С v)
(С р – С v) 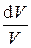 = – С v
= – С v 
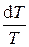 ,
,
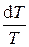 +
+ 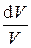
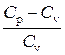 = 0.
= 0.
Обозначив 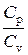 = g (показатель адиабаты), имеем
= g (показатель адиабаты), имеем
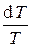 + (g – 1)
+ (g – 1) 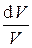 = 0.
= 0.
Интегрируя это уравнение, получим
(g – 1) ln V + ln T = const,
ln V g – 1 + ln T = const,
T V g – 1 = const.
Используя уравнение Менделеева–Клапейрона, можно записать
p V g = const.
Полученные уравнения называются уравнениями адиабаты или уравнениями Пуассона.
Термодинамические процессы. Круговые процессы (циклы).
Тепловые процессы могут быть естественными и искусственными. Естественный процесс происходит самопроизвольно, например, передача теплоты от более нагретого тела к менее нагретому. Искусственные процессы никогда не протекают самопроизвольно. При осуществлении этих процессов необходима компенсация. Искусственными процессами, например, являются сжатие газа, перенос теплоты от менее нагретого тела к более нагретому и др.
Естественные процессы, в отличие от искусственных, протекают в направлении к состоянию равновесия. Равновесным состоянием системы называется такое состояние, при котором параметры системы остаются без изменения сколь угодно долго.
Кроме того, естественные процессы протекают так, что невозможно восстановить тем же путем первоначальное состояние.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении и после его завершения и возвращения системы в исходное положение в системе и в окружающей среде не осталось изменений.
Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Необходимым и достаточным условием обратимости термодинамического процесса является его равновесность.
Равновесным процессом называется процесс, протекающий бесконечно медленно. Он складывается из непрерывного ряда равновесных состояний. Любой равновесный процесс является обратимым.
В реальных условиях обратимые процессы неосуществимы, однако с известным приближением можно некоторые процессы считать обратимыми.
 Круговым процессом или циклом называется такой процесс, при котором система, пройдя через ряд состояний, возвращается в исходное.
Круговым процессом или циклом называется такой процесс, при котором система, пройдя через ряд состояний, возвращается в исходное.
Работа, совершаемая веществом при расширении, соответствует площади под кривой I (площадь фигуры a- 1-I-2- b), эта работа положительна: А I > 0.
Работа, совершаемая веществом при сжатии, соответствует площади под кривой II (площадь фигуры a- 1-II-2- b), эта работа отрицательна: А II < 0.
Суммарная работа А = А I + А II соответствует разности площадей фигур a- 1-I-2- b и a- 1-II-2- b и соответствует заштрихованной площади 1-I-2-II, эта работа положительна.
Тогда согласно I началу термодинамики количество теплоты, переданное рабочему веществу при расширении будет определяться разностью внутренних энергий конечного U 2 и начального U 1 состояний вещества и работой совершаемой при его расширении А I:
Q I = U 2 – U 1 + А I,
а количество теплоты, отведенное от рабочего вещества при сжатии
– Q II = U 1 – U 2 + А II.
Работа, совершаемая за цикл
А = А I + А II = Q I – Q II,
 2014-01-31
2014-01-31 770
770








