ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ, ОБЪЕМА, ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ ГАЗОВ ПРИ ВЗРЫВЕ ЗАРЯДА ВЗРЫВЧАТЫХ ВЕЩЕСТВ
Лабораторная работа 2
ЗАДАЧИ
Задача 1. Определить кислородный баланс акватола 65/35.
3 а д а ч а 2. Определить кислородный баланс динитронафталина С10H6(NO2)2, имеющего относительную молекулярную массу 218.
Задача 3. Определить кислородный баланс тэна C(CH2O∙NO2)2, относительная молекулярная масса которого равна 316.
Задача 4. Определить кислородный баланс ифзанита, состоящего из 40 % аммиачной селитры, 16 % алюминиевой пудры и 44 % тротила.
Задача 5. Определить кислородный баланс алюмотола, представляющего собой сплав гранулированного тротила с 15 % алюминиевой пудры.
Задача 6. Определить кислородный баланс предохранительного аммонита ПЖВ-20, содержащего 64 % аммиачной селитры, 16 % тротила и 20 % хлористого натрия.
Задача 7. Определить кислородный баланс предохранительного ВВ, имеющего 56 % аммиачной селитры, 9 % тротила, 3 % древесной муки и 32 % хлористого натрия.
Задача 8. Определить кислородный баланс угленита, представляющего смесь следующего состава: 14,2 % нитрогликоля C2H4N206; 2,5 % древесной муки C15H22O10; 7% хлористого калия КС1; 46,3 % натриевой селитры NaNO3; 29 % хлористого аммония NH4C1; 1 % стеарата кальция С36Н70O4Са.
Задача 9. Определить кислородный баланс предохранительного аммонита АП-5ЖВ, имеющего в составе 70 % аммиачной селитры, 18 % тротила и 12 % хлористого натрия.
Задача 10. Определить кислородный баланс аммонита скального № 1, имеющего в составе 66 % аммиачной селитры NH4NO3; 5 % тротила C7H5(NO2)3 (относительная молекулярная масса равна 227); 24 % гексогена С3Н6O6N6 (относительная молекулярная масса равна 222); 5 % алюминия А1 (относительная молекулярная масса равна 27).
Задача 11. Определить кислородный баланс коллоидного хлопка C22,5H28,8O36N8,7 (относительная молекулярная масса составляет 1000).
3 а д а ч а 12. Определить кислородный баланс пироксилина C24H2909(ON02)9 (относительная молекулярная масса равна 1243).
Задача 13. Составить молекулярное уравнение граммонита 50/50.
Задача 14. Определить химическую формулу предохранительного аммонита ПЖВ-20, имеющего в составе 64% аммиачной селитры, 16 % тротила и 20 % поваренной соли..
Задача 15. Составить молекулярную формулу граммонита 30/70.
Задача 16. Определить процентное соотношение компонентов динамона с нулевым кислородным балансом на основе аммиачной селитры и древесной муки.
Задача 17. Определить молекулярную формулу ифзанита (состав приведен в задаче 4).
Задача 18. Определить химическую формулу алюмотола (состав приведен в задаче 5).
Задача 19. Определить химическую формулу предохранительного аммонита АП-5ЖВ (состав приведен в задаче 9).
Задача 20. Определить химическую формулу гранулита АС-4, имеющего в составе 92,8 % аммиачной селитры, 4 % алюминиевой пудры и 4,2 % солярового масла.
Задача 21. Составить молекулярную формулу угленита Э-6 (состав приведен в задаче 8).
Задача 22. Определить химическую формулу аммонита скального №1 (состав приведен в задаче 10).
Задача 23. Определить процентное содержание алюминия и аммиачной селитры для получения ВВ с нулевым кислородным балансом.
Задача 24. Определить химическую формулу гранулита С-2, имеющего в составе 92,8 % аммиачной селитры, 4% алюминиевой пудры и 3 % солярового масла.
Цель работы: закрепление теоретических знаний и получение практических навыков по определению основных термодинамических характеристик взрыва заряда ВВ расчетным способом.
Теплота, объем, температура и давление газов при взрыве ВВ зависят от состава образующихся продуктов взрыва и их количества.
Состав продуктов взрыва и реакции превращения промышленных ВВ в значительной степени определяются их кислородным балансом.
С точки зрения построения реакций взрывчатого превращения, ВВ делятся на три группы.
К первой относятся ВВ с количеством кислорода, достаточным для полного окисления горючих элементов. ВВ этой группы имеют нулевой или положительный кислородный баланс. Например, реакция разложения нитроглицерина имеет вид
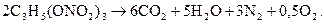
Ко второй группе относятся ВВ с количеством кислорода, достаточным для полного газообразования. Часть кислорода, входящего в состав ВВ, сначала окисляет водород в воду, углерод в окись углерода, а затем оставшаяся часть кислорода образует с окисью углерода углекислый газ. Примером может служить реакция разложения тэна:
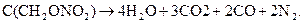
К третьей относятся ВВ с количеством кислорода, недостаточным для полного газообразования. В этом случае водород окисляется в воду, а часть углерода - в окись углерода, выделяя свободный углерод. Например, приведем реакцию разложения тротила:
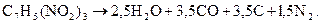
Определение теплоты взрыва. Теплотой взрыва называется количество тепла, которое выделяется при взрывчатом разложении одного моля, или 1 кг ВВ.
Теплота взрывчатого превращения может быть вычислена и определена экспериментально. В качестве стандартных условий принимают температуру 18 °С (иногда 25 °С) и давление 1,01-105 Па.
 Вычисление теплоты взрыва основано на законе Гесса, согласно которому тепловой эффект зависит не от направления протекания реакции, а только от начального и конечного состояний химической системы. В этом случае теплота взрыва равна алгебраической
Вычисление теплоты взрыва основано на законе Гесса, согласно которому тепловой эффект зависит не от направления протекания реакции, а только от начального и конечного состояний химической системы. В этом случае теплота взрыва равна алгебраической
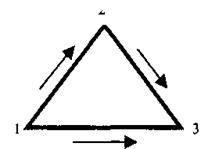
сумме теплоты образования ВВ и теплоты продуктов взрыва. Рассмотрим три состояния, графически описываемых треугольником Гесса (рис. 2.1).
Первоначальному состоянию отвечают свободные
Рис. 2.1. Треугольник Гесса: 1 – элементы, из которых состоит ВВ, второму - собственно
свободные химические элемен- ВВ, а третьему, конечному состоянию, - продукты
ты; 2 – взрывчатое вещество; взрыва. Реакция может идти по двум направлениям:
3 – продукты взрыва
1.Из свободных элементов образуется ВВ. Эта реакция характеризуется положительным или отрицательным тепловым эффектом Q1-3. Далее при взрыве ВВ образуются продукты взрыва с выделением теплоты Q2-3.
1. Из свободных элементов получаются продукты взрыва ВВ и выделяется теплота их образования Q1-3.
В соответствии с законом Гесса
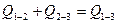
и теплота взрыва
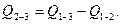 (2.1)
(2.1)
Величина Q2-3 характеризует теплоту взрыва при постоянном давлении Qp.
При охлаждении продуктов взрыва до температуры окружающей среды 15 °С (288 К) теплота взрыва при постоянном объеме Qv связана с Qp выражением
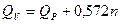 . (2.2)
. (2.2)
Если температура продуктов взрыва снижается до 25 °С (298 К), то
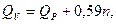 (2.3)
(2.3)
где n - число молей газообразных продуктов взрыва. Выделившаяся теплота при расчете на 1 кг ВВ
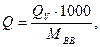 (2.4)
(2.4)
где Мвв - молекулярная масса ВВ.
Из вышеуказанного следует, что для расчета теплоты взрыва необходимо знать уравнение взрывчатого превращения ВВ.
Характеристики ВВ, их компонентов и продуктов взрыва приведены в табл. 2.1.
Пример 1. Определить теплоту взрыва нитроглицерина, взрывчатое превращение которого протекает по уравнению
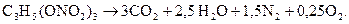
Решение. Теплота образования нитроглицерина Q1-2=351 кДж/моль (табл. 2.1).
Теплота образования продуктов взрыва
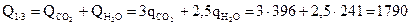 кДж/моль,
кДж/моль,
где qco2 = 396 кДж/моль и qH2O= 241 кДж/моль - теплота образования углекислого газа и паров воды соответственно. Теплота взрыва
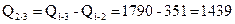 кДж/моль.
кДж/моль.
Приняв температуру среды, равной в 15 °С, по формуле (2.2) вычисляем теплоту взрыва при постоянном объеме:
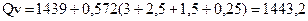 кДж/моль.
кДж/моль.
Выделившаяся теплота при молекулярной массе нитроглицерина МВB = 227 в расчете на 1 кг ВВ (2.4)
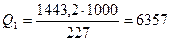 кДж/моль.
кДж/моль.
Температура газов взрыва. Температуру газов взрыва (°С) вычисляют по формуле
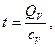 (2.5)
(2.5)
где Qv - теплота взрыва ВВ, Дж/моль; cv - средняя теплоемкость всех продуктов взрыва при постоянном объеме в интервале от 0 до Т °С, Дж/(моль∙°С).
Таблица 2.1
| Вещество | Химическая формула | Относи- тельная молекулярная масса | Теплота образования при постоянном объёме, кДж/моль | Кислородный баланс, % |
| Вода (жидкая) | H2O | |||
| Вода(газ) | H2O | |||
| Углекислота (газ) | CO2 | |||
| Окись углерода (газ) | CO | -57 | ||
| Метан (газ) | CH3 | -200 | ||
| Окись азота (газ) | NO | 90,5 | +52,2 | |
| Окись алюминия | Al2O3 | |||
| Окись кальция | CaO | 631,8 | ||
| Углекислый калий | K2CO3 | |||
| Аммиачная селитра | NH4NO3 | +20 | ||
| Азотнокислый калий | KNO3 | +39,6 | ||
| Азотнокислый натрий | NaNO3 | - | +42,4 | |
| Тротил | C7H5(NO2)3 | 56,5 | -74 | |
| Динитронафталин | C10H6O4N2 | 35,2 | -139,4 | |
| Тетрил | C7H5O8N5 | 41,8 | -47,2 | |
| Гексоген | C3H6O6N6 | 87,4 | -21,6 | |
| Тэн | C5H8O12N4 | 512,9 | -10,1 | |
| Нитроглицерин | C3H5(ONO2)3 | 350,7 | +3,5 | |
| Нитрогликоль | C2H4(ONO2)2 | 233,6 | ||
| Коллойдный хлопок (12,2 %) | C22,5H28,8O36N8,7 | 2722,2 | -33,5 | |
| Гремучая ртуть | Hg(CNO)2 | 284,5 | 273,6 | -11,3 |
| Стеарат кальция | C36H70O4Ca | -274,1 | ||
| Бумага (целлюлоза) | C10H6O5 | 946,9 | -180 | |
| Древесная мука | C15H22O10 | - | -137 | |
| Парафин | C24H5O | 338,5 | - | -346 |
| Алюминий | Al | - | -89 | |
| Хлористый натрий | NaCl | 58,5 | - | |
| Хлористый калий | KCl | 74,5 | - | |
| Сернокислый калий | K2SO4 | 1442,2 | ||
| Аммиак | NH3 | -141 | ||
| Хлористый аммоний | NH4Cl | 53,5 | - | -59,8 |
| Тринитрофенолят аммония | C6H2(NO2)3ONH4 | 113,2 | -52 |
Теплоемкость в зависимости от температуры определяют по формуле
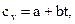 (2.6)
(2.6)
где a, b - коэффициенты, найденные опытным путем.
Решив совместно уравнения (2.5) и (2.6), получим
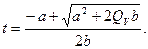 (2.7)
(2.7)
Теплоемкость следующих газов в зависимости от температуры находят по формулам:
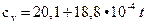 Дж/(моль∙°С) - двухатомные; (2.8)
Дж/(моль∙°С) - двухатомные; (2.8)
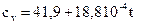 Дж/(моль∙°С) - четырехатомные; (2.9)
Дж/(моль∙°С) - четырехатомные; (2.9)
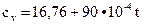 Дж/(моль∙°С) - пары воды; (2.10)
Дж/(моль∙°С) - пары воды; (2.10)
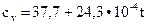 Дж/(моль∙°С) - углекислый газ; (2.11)
Дж/(моль∙°С) - углекислый газ; (2.11)
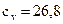 Дж/(моль∙°С) - твердые продукты; (2.12)
Дж/(моль∙°С) - твердые продукты; (2.12)
Теплоемкость смеси газов рассчитывают по формулам (2.8)-(2.12), учитывая долевое участие каждого из составляющих и выполняя их почленное сложение, чтобы найти суммарные величины ∑а и ∑Ь. При этом расчетная формула принимает вид
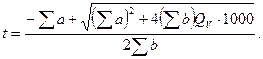 (2.13)
(2.13)
Рассмотрим порядок расчета температуры взрыва ВВ на примере.
Пример 2. Вычислить температуру взрыва нитроглицерина, если теплота взрыва нитроглицерина равна 1443 кДж/моль.
Решение. Теплоемкость всех продуктов взрыва (см. пример 1) определяем на основе вышеприведенных формул.
Для ЗСO2 она равна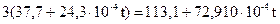 ;
;
для 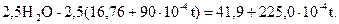
Итого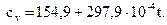
Следовательно, 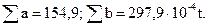
Подставив найденные значения в формулу (2.7), получим
 2013-12-31
2013-12-31 1502
1502
