Химический состав белков
Белки
Лекция 2
(2 часа)
Функции белков
Химический состав белков
Характеристика протеиногенных аминокислот
Структура белков
Классификация белков
Свойства белков и методы исследования
Белки являются структурными компонентами органов и тканей, проявляют ферментативную активность (ферменты), участвуют в регуляции метаболизма. Транспортные белки, переносящие протоны и электроны через мембраны обеспечивают биоэнергетику: поглощение света, дыхание, выработку АТФ. Запасные белки (характерны в основном для растений) откладываются в семенах и используются для питания проростков в процессе прорастания. Сжигая АТФ, белки обеспечивают механическую деятельность, участвуют в движении цитоплазмы и других клеточных органелл. Важна защитная функция белков: гидролитические ферменты лизосом и вакуолей расщепляют вредные вещества, попавшие в клетку; гликопротеины участвуют в защите растений от патогенов; белки выполняют криозащитную и антифризную функции. Один белок может выполнять две или более функций (некоторые белки мембран могут выполнять структурную и ферментативную функции).
Удивительное разнообразие функций белков и большая распространенность отразились в их названии – протеины (от греческого «рrоtos» - первичный, важнейший). Как правило, содержание белков в растениях ниже, чем у животных: в вегетативных органах количество белка обычно 5-15% от сухой массы. Так, в листьях тимофеевки содержится 7% белка, а в листьях клевера и вики – 15%. Больше белка в семенах: у злаков в среднем 10-20%, у бобовых и масличных – 25-35%. Наиболее богаты белком семена сои – до 40%, а иногда и выше.
В растительных клетках белки обычно связаны с углеводами, липидами и другими соединениями, а также с мембранами, поэтому их трудно извлекать и получать чистые препараты, особенно из вегетативных органов. В связи с этим в растениях лучше изучены белки семян, где их больше и откуда они легче извлекаются.
Белки – органические соединения, имеющие следующий элементарный состав: углерод 51-55 %; кислород 21-23 %; водород 6,6-7,3 %; азот 15-18 %; сера 0,3-2,4 %. В состав некоторых белков входит также фосфор (0,2-2 %), железо и другие элементы. Характерным показателем элементарного состава белков у всех организмов является наличие азота, в среднем его принимают равным 16 %. Относительное постоянство этого показателя дает возможность использовать его для количественного определения белка: относительное значение содержания белкового азота, в процентах, умножают на фактор пересчета – 6,25 (100: 16 = 6,25). По химической природе белки – гетерополимеры, построенные из остатков аминокислот. Аминокислотами (АК) называются органические соединения, в молекулах которых один или несколько атомов водорода замещены аминогруппами (—NН2).
В составе белков обнаружено 20 аминокислот (протеиногенных). Несмотря на огромное разнообразие вариантов последовательностей аминокислот в белках, каждый конкретный белок отличается строгим постоянством состава АК и их последовательности. Все АК, входящие в состав белков, являются α-аминокислотами, поскольку их аминогруппа (— NH2) находится в α-положении, т.е. рядом с карбоксильной:
R
|
Н—С—NН2 R— боковые цепи (боковые радикалы)
|
СООН
Существует 4 основных класса АК, содержащих R-группы следующих типов:
1. Неполярные или гидрофобные – аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, триптофан. R – представлены углеводородными остатками;
2. Полярные (гидрофильные), но незараженные – глицин, серин, треонин, цистеин, тирозин, аспарагин, глутамин. R – полярные незаряженные группы;
3. Отрицательно заряженные (кислые) – аспарагиновая кислота, глутаминовая кислота. R – отрицательно заряженные полярные гидрофильные;
4. Положительно заряженные (основные) – лизин, аргинин, гистидин. R – положительно заряженные гидрофильные.
АК – амфотерные электролиты, так как аминогруппа имеет основные свойства, а карбоксильная – кислотные. В водных растворах в интервале рН от 4 до 9 АК существуют преимущественно в виде биполярных ионов – цвиттер-ионов:
R
|
СНNН3 +
|
СОО —
В кислой среде карбоксил нейтрализуется – АК реагирует как катион:
R R
| |
СНNН3+ + Н+ СН–NН3+

 | |
| |
СОО— – Н+ СООН
Биполярный ион Катион
В щелочной среде цвиттер-ион АК теряет протон – АК реагирует как анион:
R R
| |
СНNН3+ + ОН СН–NН2 + Н2О

 | |
| |
СОО— – ОН СОО—
При нейтральном рН карбоксильные группы АК полностью диссоциированы. В биохимической литературе такие АК принято обозначать с использованием окончания (-ат), например: глутаминовая кислота – глутамат, пировиноградная – пируват и т. д.
Для всех АК характерны реакции с участием аминогрупп, карбоксильных групп или реакционноспособных групп в боковых цепях (— SH, — S — S —, — ОН и др.). Поэтому АК могут реагировать как с основаниями, так и с кислотами, образуя соли:
R R
| |
СНNН2 СНN+Н3 Cl—
| |
СООNa СООН
Натриевая соль Солянокислая соль
При взаимодействии АК с азотистой кислотой образуются гидроксикислота и газообразный азот. Реакция лежит в основе количественного определения АК по методу Д. Ван Слайка.
R R
| |
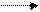 CHNH2 + HNO2 СНОН + N2 + Н20
CHNH2 + HNO2 СНОН + N2 + Н20
| |
СООН СООН
Аминогруппа АК легко вступает в реакцию с формальдегидом с образованием метиленаминокислот:
R O R
| // |
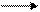 CHNH2 + HC СН–N=CH2 + Н20
CHNH2 + HC СН–N=CH2 + Н20
| \ |
СООН H СООН
После блокирования аминогрупп свободные карбоксильные группы можно оттитровать щелочью. На этой реакции основан метод формольного титрования, который применяют для количественного определения АК.
Карбоксильная группа может реагировать со спиртами, образуя сложные эфиры:
О
//
 R–СН–СООН + С2Н5ОН R–СН–С + H2О
R–СН–СООН + С2Н5ОН R–СН–С + H2О
| | \
NH2 NH2 О–С2Н5
Эта реакция используется для разделения и определения АК помощью фракционной перегонки их эфиров в вакууме.
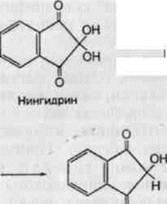
Специфическая реакция нингидрина (трикетогидринденгидрата) с α-аминокис-лотами обнаруживает и количественно определять маленькие концентрации АК:
|

О
Гидриндантин реагирует с избытком нингидрина в присутствии аммиака, при этом образуется комплексное соединение сине-фиолетового цвета с максимумом поглощения около 570 нм.
Все АК, за исключением глицина, имеют асимметрический атом углерода (т.е. атом углерода с четырьмя различными заместителями) и поэтому являются оптически активными соединениями. Все АК, встречающиеся в белках, принадлежат к L-ряду.
Следует учитывать, что символы L и D относятся к абсолютной конфигурации аминокислот, а не к направлению вращения плоскости поляризации света, которое в настоящее время принято обозначать знаком (+) или (—).
Такие L-аминокислоты, как гистидин, лейцин, метионин, цистеин, треонин, фенилаланин, в нейтральных водных растворах являются левовращающими, в то время как аланин, валин, изолейцин, аргинин, лизин и некоторые другие – правовращающими.
Высшие растения и большинство микроорганизмов синтезируют все 20 АК, входящих в состав белков. Применительно к животным организмам АК можно разделить на две группы: заменимые и незаменимые. Заменимые АК синтезируются в организме, а незаменимые должны поступать с пищей. Биологическая ценность белков определяется содержанием в них незаменимых АК. Аминокислоты могут быть производными жирных и ароматических кислот. В связи с этим выделяют две группы АК: ациклические (алифатические) и циклические.
 2013-12-31
2013-12-31 847
847








