Ациклические аминокислоты. В зависимости от количества карбоксильных и аминных групп различают моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые и диаминодикарбоновые кислоты.
Моноаминокарбоновые кислоты. АК этой группы содержат 1 аминогруппу и 1 карбоксильную группу.
Глицин (гликокол), или α-аминоуксусная кислота, образуется при гидролизе белков и синтезируется в организме.
H—СН2— СООН
|
N H2
Является предшественником в синтезе ряда биологически активных соединений: пуринов, порфиринов, глутатиона, креатина, гликолевой и гиппуровой кислот.
α-Аланин, или α-аминопропионовая кислота.
Н3С—СН2— СООН
|
N H2
Аланин и его производные составляют 60-65 % АК, содержащихся в белках. Образуется при гидролизе белков и синтезируется в организме.
Серин, или -амино-β-оксипропионовая кислота. Является одним из компонентов, входящих в состав активных центров ферментов. Гидроксильные группы остатков серина в молекулах белков метаболически активны и способны фосфорилироваться под контролем специфических протеинкиназ:
| СООН | H2N—СН | СН2ОН | СООН | H2N—СН | СН2ОРО3Н2 | |
| Серин | Фосфосерин |
Фосфосерин входит в состав сложных белков – фосфопротеидов. Серин образуется при гидролизе белков и синтезируется в организме.
Цистеин, или α-амино-β-тиопропионовая кислота. Получен в 1890 г. из белков волос, рогов, копыт некоторых животных. Это нестойкое соединение характеризуется наличием сульфгидрильной группы SH:
СООН
|
H2N—СН
|
СН2SН
Сульфгидрильная группа этой АК легко окисляется. Цистеин входит в состав структурных белков и многих ферментов.
β-Аланин, или β-аминопропионовая кислота. Входит в состав коэнзима А, пантотеновой кислоты, ансерина и карнозина. В составе белков β-аланин не обнаружен.
α-Аминомасляная кислота В составе белков не обнаружена.
γ-Аминомасляная кислота. В составе белков не обнаружена. Образуется при декарбоксилировании глутаминовой кислоты.
| СООН | H2N—СН | СН2 | СН3 | СООН | СН2 | СН2 | СН2—NH2 |
| α-Аминомасляная кислота | γ-Аминомасляная кислота |
Метионин, или α-амино-γ-метилтиомасляная кислота. Это серосодержащая аминокислота, которая имеет также подвижную метильную группу. Метионин является предшественником универсального донора метильных групп в процессах переметилирования S-аденозилметионина. Участие метионина в процессах переметилирования, например, в синтезе холина, обусловливает его липотропное действие. При отщеплении от метионина метильной группы образуется гомоцистеин:
| СООН | H2N—СН | СН2 | СН2—S—СН3 | СООН | H2N—СН | СН2 | СН2—SН |
| Метионин | Гомоцистеин |
Треонин, или α-амино-β-оксимасляная кислота. В организме не синтезируется. Имеет два асимметрических атома углерода (в α- и β-положениях) и может находиться в виде четырех изомеров. Оксигруппа треонина может фосфорилироваться:
| СООН | H2N—СН | СН—ОН | СН3 | СООН | H2N—СН | СН—О—РО3Н2 | СН3 |
| Треонин | Фосфотреонин |
Валин или а-аминовалериановая кислота, α-амино-β-метилмасляная кислота. Валин присутствует во многих белках, но обычно содержание его невелико:
Н3С NH2
\ |
СН—СН—СООН
/
Н3С
Лейцин, или α-аминоизокапроновая кислота и и золейцин α-амино-β-метил-валериановая кислота. В организме не синтезируются.
Норлейцин или α-аминокапроновая кислота. В белках обнаружен в незначительных количествах.
| СООН | H2N—СН | СН2 | СН / \ Н3С СН3 | СООН | H2N—СН | СН / \ Н3С С Н2 | СН3 | СООН | H2N—СН | СН2 | СН2 | СН2 | СН3 |
| Лейцин | Изолейцин | Норлейцин |
Моноаминодикарбоновые кислоты. АК этой группы содержат 1 аминогруппу и 2 карбоксильные.
Аспарагиновая кислота, или аминоянтарная кислота:
N H2
|
НООС—С Н2—СН—СООН
Выделена в 1868 г. в виде амида из спаржи.
Глутаминовая кислота, или α-аминоглутаровая кислота:
N H2
|
НООС—С Н2—С Н2—СН—СООН
Выделена в 1869 г. из гидролизатов белков пшеничного зерна. Входит в состав белков и других соединений. Является предшественником в синтезе глутатиона. Играет исключительно важную роль в процессах переаминирования АК и обезвреживания аммиака. Синтезируется в организме и образуется при гидролизе белков. В состав белков входят производные аспарагиновой и глутаминовой кислот – амиды аспарагин и глутамин:
| N H2 N H2 | | О=С—С Н2—СН—СООН | N H2 N H2 | | О=С—С Н2—С Н2—СН—СООН |
| Аспарагин | Глутамин |
Диаминомонокарбоновые кислоты. Содержат 2 амино- и 1 карбоксильную группу.
Лизин. Незаменимая АК гистонов, протаминов, белков рибосом.
N H2
|
H2N —С Н2—С Н2—С Н2—С Н2—СН—СООН
Оксилизин, или α-диамино-δ-оксикапроновая кислота, производное лизина:
N H2
|
H2N —С Н2—С Н2—С Н2—С Н2—СН—СООН
|
ОН
Аргинин, или α-амино-δ-гуанидинвалериановая кислота входит в растительные белки, особенно белков хроматина (гистонов и протаминов). Незаменимая АК.
| СООН | H2N—СН | СН2 | СН2 | СН2 | NH | C=NH | NH2 | СООН | H2N—СН | СН2 | СН2 | СН2 | NH | C=NH | NH—РО3Н2 |
| Аргинин | Аргининфосфорная кислота |
Орнитин, или α-, δ-диаминовалериановая кислота:
NH2
|
NH2— СН2— СН2— СН2— СН— СООН
В составе белков находится в незначительных количествах.
Цитруллин или α-амино-δ-уреидовалериановая кислота: В белках не обнаружен.
NH2
|
NH2— СО— NH— (СН2)3— СН— СООН
Диаминокарбоновые кислоты содержат по 2 амино- и по 2 карбоксильные группы.
Цистин или β,β'-дитио-α,α'-аминокротоновая кислота:
СООН СООН
| |
H2N —С Н H2N—С Н
| |
С Н2 —S—S —С Н2
Играет важную роль в формировании и поддержании нативной структуры белков, а также в окислительно-восстановительных реакциях. Образуется при распаде белков и метаболизме аминокислот серина и метионина, а также при конденсации двух молекул цистеина.
Циклические аминокислоты. Среди этих АК имеются производные гомо- и гетероциклических соединений.
Гомоциклические аминокислоты.
Фенилаланин, или α-амино-β-фенилпропионовая кислота. Незаменимая АК. Является предшественником биосинтеза гормонов: адреналина, норадреналина, тироксина и др.
Тирозин, или α-амино-парагидроксифенилпропионовая кислота. Незаменимая АК при отсутствии фенилаланина в пище.
Гетероциклические аминокислоты.
Триптофан, или α-амино-β-индолилпропионовая кислота. Относится к гетероциклическим АК, так как пиррольное ядро триптофана содержит гетероатом азота. При декарбоксилировании превращается в биологически активное соединение триптамин, вызывающее повышение кровяного давления. Н езаменимая АК.
Гистидин, или α-амино-β-имидазолилпропионовая кислота. Остаток гистидина частично входит в состав активных центров ферментов РНК-азы, химотрипсина, транскетолазы и др. При декарбоксилировании гистидина образуется биологически активный амин – гистамин, медиатор парасимпатической нервной системы:
Пролин, или пирролидин-2-карбоновая кислота. Иминокислота, т.к. нет NH-группы в главной цепи, т.е. у него в двое меньше возможности завязывать водородные связи, на которых держится вторичная структура белка. Богаты пролином проламины (до 10-15 %). Производным пролина является гидроксипролин.
Гидроксипролин, или 4-гидроксипирролидин-2-карбоновая кислота. Иминокислота. Пролин и гидроксипролин играют важную роль в формировании нативной структуры белка.
В растениях обнаружено большое количество аминокислот (свыше 250), не входящих в состав белков, а содержащихся только в свободном состоянии или в составе коротких пептидов. Эти непротеиногенные АК присутствуют пептидах в небольших количествах и обычно характерны для небольшой группы растений (семейство, род).
АК являются мономерными структурными единицами белковой молекулы из которых сложена полипептидная цепь. АК могут находиться в двух стерических формах: L- и D-. Эти формы зеркально симметричны. В них массивный боковой радикал R и Н-атом, стоящие при α-углероде меняются местами. Этих форм нет только у глицина, боковая цепь которого состоит из Н-атома. Боковые цепи сложены из остатков L- аминокислот, только они кодируются генами. D-остатки не кодируются при матричном синтезе белка, а синтезируются специальными ферментами. Рецемизация (переход L- в D-) при биосинтезе, а также спонтанно в белках практически не происходит, но часто встречается при химическом синтезе пептидов.
Белковая молекула характеризуется наличием прочных ковалентных и относительно слабых нековалентных связей. Такое сочетание ковалентных и нековалентных связей обеспечивает белковой молекуле определенную прочность и динамичность в процессе функционирования (рис.1).
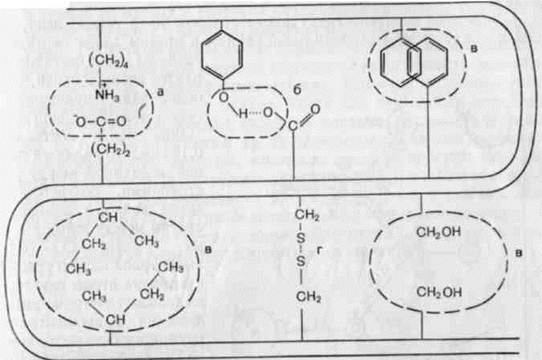
а – электростатическое взаимодействие; б – водородные связи; в – взаимодействие неполярных боковых цепей, вызванное выталкиванием гидрофобных радикалов в «сухую» зону молекулами растворителя; г – дисульфидные связи (двойная изогнутая линия обозначает хребет полипептидной связи).
Рисунок 1 – Типы связей в белковой молекуле (по Филипповичу).
Ковалентные связи в молекуле белка могут быть двух типов – пептидные и дисульфидные. АК в белковой цепи связаны между собой пептидными связями С и N атомов. Пептидная, или кислотноамидная связь (—СО—NH—), является типичной ковалентной связью. Пептидная связь возникает при взаимодействии карбоксильной группы одной АК и аминогруппы другой. Свободные амино- и карбоксильные группы образованного дипептида способны вновь вступать в реакцию поликонденсации с новыми молекулами АК, с образованием высокомолекулярного соединения. Таким образом, с помощью пептидной связи аминокислотные остатки соединяются друг с другом, образуя регулярный остов белковой молекулы, от которого отходят разнообразные боковые группы (R1 …RМ). Число звеньев боковой цепи (М) кодируется геном и составляет от нескольких десятков до многих тысяч. В процессе биосинтеза белка происходит соединение остатков отдельных аминокислот друг с другом в линейную последовательность:
—NH—CH—CO—NH—CH—CO— …—NH—CH—CO—
| | |
R1 R2 RМ
Соединения, которые образуются в результате конденсации нескольких АК, получили название пептидов (ди-, три-, тетрапептиды и т. д.). В состав пептидов могут входить не только протеиногенные, но и непротеиногенные АК. Пептиды играют важную роль промежуточных продуктов в обмене веществ, и многие из них являются физиологически очень активными соединениями. Пептидами являются некоторые антибиотики (грамицидин, лихениформин), гормоны (инсулин, окситацин, вазопрессин), токсины (аманитины). Пептиды могут представлять собой замкнутую полипептидную цепочку, т. е. являться циклопептидами, а некоторые даже имеют бициклическое строение. Среди циклопептидов есть сильно токсичные вещества (ядовитый гриб бледная поганка (Amanita phalloides).
Названия пептидов определяются наименованиями входящих в его состав АК, перечисляемых последовательно, начиная с N-конца, причем суффикс -ин- в названиях всех АК, за исключением С-концевой, имеющей свободную СООН-группу (карбоксильную), заменяется на суффикс -ил. Например, если в образовании три пептида принимают участие две молекулы аланина и одна молекула глицина, трипептид называют аланилаланилглицином или алаалагли. Сокращенно аминокислоты обозначают трехбуквенными символами (таблица 1).
Таблица 1 – Сокращенные обозначения аминокислот
| Аминокислота | Сокращенное обозначение | Аминокислота | Сокращенное обозначение |
| Аланин | Ала | Лейцин | Лей |
| Аргинин | Арг | Лизин | Лиз |
| Аспарагин | Асн | Метионин | Мет |
| Аспарагиновая к-та | Асп | Фенилаланин | Фен |
| Цистеин | Цис | Пролин | Про |
| Глутамин | Глн | Серии | Сер |
| Глутаминовая к-та | Глу | Треонин | Тре |
| Глицин | Гли | Триптофан | Три |
| Гистидин | Гис | Тирозин | Тир |
| Изолейцин | Иле | Валин | Вал |
Важную роль в стабилизации пространственной структуры белковой молекулы играют ковалентные дисульфидные связи(—S—S—), которые образуются в результате окисления сульфгидрильных групп остатков цистеина. Дисульфидные связи могут образовываться между остатками цистеина двух полипептидных цепей или двумя остатками цистеина одной полипептидной цепи, стабилизируя при этом определенную конформацию белковой молекулы. В стабилизации конформации белковой молекулы существенную роль играют нековалентные связи и взаимодействия. К ним относятся гидрофобные, электростатические, ионные взаимодействия, а также водородные связи. Они поддерживают пространственное строение белка значительно слабее химических связей, фиксирующих последовательность мономеров (АК) в белковой цепи.
Гидрофобное взаимодействие возникает при сближении гидрофобных углеводородных и ароматических радикалов некоторых аминокислот (аланина, валина, лейцина, изолейцина, фенилаланина и триптофана). Процесс гидрофобного взаимодействия можно представить как перемещение неполярных групп полипептидной цепи (метильной —СН3, этильной —С2Н5, фенильной —С6Н6) из воды в гидрофобные области, образуемые за счет ассоциации этих групп. Вследствие такого перемещения неполярные группы сказываются в непосредственной близости друг от друга во внутренней части молекулы, а гидрофильные группы размещаются на поверхности и контактируют с водой.
Водородные связи образуются между атомами водорода, ковалентно соединенными с атомом, содержащим неподеленную электронную пару, или другим электроотрицательным атомом. В биологических структурах водородная связь чаще всего образуется за счет атома водорода, связанного с кислородом или азотом. Водородные связи могут быть внутри- и межцепочечными. Внутрицепочечные водородные связи стабилизируют α-спиральные, а межцепочечные – β-складчатые структуры.
Ионные (солевые) связи. Они, предположительно, образуются между диссоциированными свободными карбоксильными группами (СОО—) моноаминодикарбоновых аминокислот (глутаминовой и аспарагиновой) и протонированными свободными аминогруппами (NH3+) диамино-монокарбоновых аминокислот. Ионные связи могут быть внутри- и межцепочечными.
Уровни структурной организации молекулы белка. Функциональные свойства белков определяются последовательностью АК и их пространственной структурой. С этой точки зрения выделяют четыре уровня: первичная, вторичная, третичная и четвертичная структуры.
Под первичной структурой понимают качественный и количественный состав АК, а также их последовательность расположения в полипептидных цепях белковой молекулы. Молекула белка может иметь одну или несколько полипептидных цепей. Например, молекула фермента рибонуклеазы представляет одну полипептидную цепь, имеющую восемь остатков цистеина, образующих четыре внутримолекулярные дисульфидные связи. Гормон инсулин состоит из двух полипептидных цепей, связанных дисульфидными мостиками между остатками цистеина.
 2013-12-31
2013-12-31 1919
1919
