ИЗУЧЕНИЕ СПЕКТРА АТОМА ВОДОРОДА
Цель работы: Исследовать спектр атомарного водорода, вычислить постоянную Ридберга.
Приборы и принадлежности: Монохроматор, газосветные трубки с водородом.
Введение
Спектр испускания возникает при переходе атома из более возбуждённого состояния в менее возбуждённое. Величина испущенного кванта энергии определяется разностью энергетических уровней начального и конечного состояний.
В простейшем случае (атом водорода) сказанное можно проиллюстрировать небольшим расчётом с использованием постулатов Бора и второго закона Ньютона (сила кулоновского притяжения ядром электрона сообщает ему нормальное ускорение).
Постулаты Бора
Первый постулат
Существуют стационарные состоянии, находясь в которых, атом не излучает и не поглощает энергию.
Стационарными являются такие состояния, для которых выполняется условие:
mur = niħ (ni = 1, 2, 3,…),
где m – масса электрона, u – скорость электрона, r – радиус его орбиты, ħ = h /(2p) = 1,03×10-34 Дж/с – постоянная Планка.
Второй постулат
При переходе атома из состояния с энергией Wj в состояние с энергией Wi испускается или поглощается один фотон частотой nФ, энергия которого рассчитывается по формуле
E Ф = h nФ = Wj - Wi.
Если Wi < Wj, происходит излучение фотона, если Wi > Wj, – поглощение фотона.
Для атома водорода уравнения, описывающие поведение электрона, имеют вид:
mur = niħ, (1)
 =
=  . (2)
. (2)
Решая систему, можно получить значения r и u на соответствующей орбите.
Полная энергия электрона:
W = W К + W П =  -
- 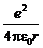 = -
= - 
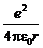 . (3)
. (3)
Подставив r и u из уравнений (1) – (2) в уравнение (3), получим:
W = - 
 .
.
Отсюда:
nФ = 
 .
.
Множитель  обозначается буквой R и называется постоянной Ридберга; R = 3,29×1015 c-1.
обозначается буквой R и называется постоянной Ридберга; R = 3,29×1015 c-1.
Линейчатые спектры обусловлены испусканием электромагнитного излучения свободными или слабо связанными атомами. Одним из источников такого излучения является возбужденный газ или пар. В данной работе используются газосветные трубки, наполненные водородом и неоном.
Установлено, что спектральные линии атомарного водорода обнаруживают несложные закономерности. Частоты соответствующих линий могут быть определены по формуле
ν = R  (4)
(4)
где ν – частота, ν = c /l, с –скорость света в вакууме, λ – длина волны, R - постоянная Ридберга, ni и nj – целые числа, причем nj может принимать значения (ni + 1),(ni + 2),(ni + 3),....
Рассмотрим переход атома из различных возбужденных состояний на один и тот же энергетический уровень, определяемый квантовым числом ni. Совокупность спектральных линий, отвечающая таким переходам, образует серию. Таким образом, ni определяет серию. Соответственно квантовое число nj определяет энергетический уровень, с которого имел место данный переход, то есть линию в серии.
Различным сериям атома водорода: Лаймана, Бальмера, Пашена, Брэккета, Пфунда отвечают соответственно значения ni = 1, 2, 3, 4, 5.
Рассмотрим, как определить частоты спектральных линий атома водорода, принадлежащих серии Бальмера, используя комбинационный принцип, математическое выражение которого представлено равенством (2). Для серии Бальмера ni = 2, nj = 3, 4, 5... Следовательно,
ν = Rc 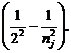 (5)
(5)
Если приписать nj значения соответственно 3, 4, 5, 6, то из уравнения (5) получим значения частот спектральных линий, лежащих в видимой области и обозначаемых в спектроскопии H a H b Hγ, H d. По мере увеличения nj разность частот соседних линий уменьшается, и при nj → ¥ сами частоты стремятся к пределу
nГР = R 
где nГР– частота, соответствующая границе серии Бальмера. У каждой серии есть своя граница, соответствующая ей частота определяется соотношением:
nГР = R 
Рассмотрим физический смысл nГР. Согласно Бору, при переходе атома с более высокого j -го энергетического уровня на менее высокий i -й уровень излучается квант энергии
hν = Ej - Ei (6)
Соответственно, чтобы перевести электрон с уровня i на уровень j, необходимо сообщить ему такую же энергию.
Частота νгропределяет энергию (Е = h nГР), которую надо сообщить электрону, чтобы удалить его с уровня, определяемого числом и, в пространство за пределы атома, где его полная энергия должна быть равна нулю.
Описанный процесс называется процессом ионизации, а Е = h nГР является энергией ионизации атома в данном состоянии.
Эта величина связана с потенциалом ионизации простым соотношением: j = h nГР/ e, где e – элементарный заряд, равный 1,6×10-19 Кл.
Процесс обратный ионизации: захват электрона атомом будет сопровождаться излучением света.
Поскольку электрон, отделенный от атома, может обладать произвольной кинетической энергией W К, то при его захвате ионом должна освобождаться энергия (h nГР + W К). Следовательно, согласно второму постулату Бора (1) в этом случае будет испускаться электромагнитное излучение с частотой
ν = 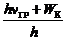 = nГР +
= nГР + 
Таким образом, возможно излучение с частотой, большей нежели частота границы серии, на любую величину W К/ h. Это означает, что к границе серии со стороны высоких частот прилегает сплошной спектр. Излучение спектров испускания позволяет исследовать строение атома.
Приборы и оборудование
Схема установки приведена на рис. 1. Установка содержит излучатель 1 и монохроматор 2. Блок излучателя содержит лампу ТВС-15, заполненную водородом, устройство ее питания и кодиро
 |
вочный узел.
Монохроматор предназначен для выделения и исследования монохроматического излучения в спектральном диапазоне от 2000 до 8000 ангстрем. Для наблюдения спектра на выходной патрубок надевается окуляр, положение которого регулируется наблюдателем. Сканирование спектра осуществляется вращением ручки 3 рядом с индикатором цифрового счетчика длин волн 4. Первые три цифры счетчика 4 соответствуют длине волны в нм, по барабану с рисками отсчитываются десятые доли нм в том же окне.
Внимание! Перед включением необходимо проверить заземление излучателя.
 2018-03-09
2018-03-09 226
226







