Лабораторная работа № 2 (7К)
Основы термодинамики
Цели работы: исследование термодинамических процессов, производимых в идеальном газе. Проверка первого начала термодинамики, расчет теплоемкости газа.
Основы теории
Раздел физики, изучающий свойства тел без использования представлений о характере движения и взаимодействия частиц, из которых они состоят, называется термодинамикой.
Термодинамика рассматривает свойства тел и явления, происходящие в них, опираясь на общие законы (начала) термодинамики. Законы термодинамики и молекулярно-кинетическая теория дополняют друг друга.
Первоначально термодинамика возникла как наука об использовании теплоты для получения работы (теоретическая теплотехника). Одновременно были открыты законы термодинамики, обладающие большой общностью. Эти законы относятся к преобразованиям энергии, ее изменениям в различных процессах и к ряду связанных с ней величин. Поэтому основное содержание современной термодинамики можно определить как учение о наиболее общих свойствах макроскопических систем и о закономерностях тепловых, а также ряда других физических явлений.
Внутренняя энергия. Одним из важнейших параметров термодинамической системы является ее внутренняя энергия. Внутренней энергией системы называют ту часть ее полной энергии, которая определяется собственными параметрами этой системы. Внутренняя энергия тела складывается из кинетической энергии хаотического теплового движения и потенциальной энергии их взаимодействия. Кинетическая и потенциальная энергии тела как целого во внутреннюю энергию не входят.
Внутренняя энергия идеального газа. Внутренняя энергия идеального газа представляет собой сумму кинетических энергий теплового движения его частиц. В статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы. На каждую поступательную и вращательную степень свободы приходится энергия, равная 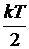 , на каждую колебательную – кТ.
, на каждую колебательную – кТ.
При этом без учета колебательных степеней свободы, которые "включаются" при высоких температурах, для одноатомного газа i = 3, для двухатомного i = 5, для многоатомного i = 6.
Средняя кинетическая энергия молекул газа, таким образом, равна 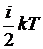 . Поэтому внутренняя энергия идеального газа, состоящего из N молекул,
. Поэтому внутренняя энергия идеального газа, состоящего из N молекул, 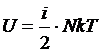 .
.
 Так как
Так как 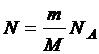 , то
, то 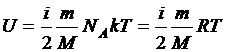 .
.
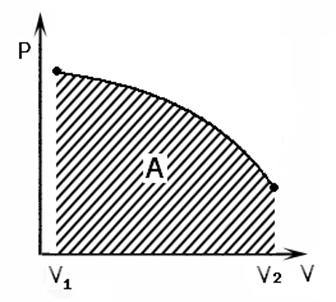
Рис.1. Работа в термодинамике
Внутренняя энергия идеального газа зависит только от одного параметра – его абсолютной температуры: U = f(T).
Работа в термодинамике. По определению работы δA=Fdl, но F=pS, a Sdl = dV => δA = pdS.
Тогда полная работа
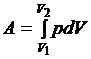 .
.
Как видно из полученного выражения, работа положительна при увеличении объема и отрицательна при его уменьшении. Согласно свойствам интеграла, работа также определяется площадью под кривой процесса в координатах рV (рис.1).
Первый закон термодинамики. Внутренняя энергия изолированной термодинамической системы может изменяться двумя способами: при совершении работы и при теплообмене (теплопередаче).
В термодинамической системе количество переданной теплоты δQ идет на изменение внутренней энергии dU и совершение системой работы δA внешних сил:
δQ = dU+δA.
Первое начало термодинамики является законом сохранения энергии для термодинамических процессов.
Применение первого закона термодинамики к различным процессам
Изотермический процесс. В идеальном газе внутренняя энергия определяется абсолютной температурой. При изотермическом расширении или сжатии газа его температура не меняется. В изотермическом процессе изменение внутренней энергии равно нулю: 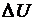 = 0. На основании первого закона термодинамики при изотермическом расширении газа переданное количество теплоты Q равно работе А, совершенной газом: Q = A.
= 0. На основании первого закона термодинамики при изотермическом расширении газа переданное количество теплоты Q равно работе А, совершенной газом: Q = A.
Работа же в данном процессе
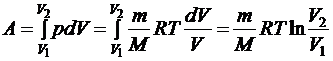 .
.
Изохорный процесс. При изохорном процессе работа газа равна нулю, поэтому изменение внутренней энергии 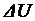 идеального газа равно полученному количеству теплоты Q.
идеального газа равно полученному количеству теплоты Q.
Итак, при изохорном процессе Q = ∆ U = 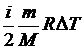 .
.
Изобарный процесс. Изобарное расширение газа происходит при передаче ему количества теплоты Q. В результате нагревания газа происходит увеличение его внутренней энергии и совершение работы расширения: 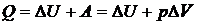 .
.
Адиабатный процесс. Адиабатным называется процесс изменения объема, давления и температуры газа при отсутствии теплообмена с окружающими телами, то есть при условии Q = 0.
При адиабатном расширении газ совершает работу за счет уменьшения внутренней энергии: 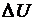 = – А. Поэтому температура газа при адиабатном расширении понижается. Используя полученное выражение, а также уравнение состояния идеального газа, можно получить уравнение адиабатного процесса (уравнение Пуассона):
= – А. Поэтому температура газа при адиабатном расширении понижается. Используя полученное выражение, а также уравнение состояния идеального газа, можно получить уравнение адиабатного процесса (уравнение Пуассона):
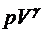 =const,
=const,
где 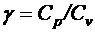 –коэффициент Пуассона.
–коэффициент Пуассона.
Теплоемкость газов. Теплоемкостью называется количество теплоты, необходимой для нагревания тела на 1 К. Для анализа теплоемкости газов удобно использовать молярную теплоемкость, которая равна количеству теплоты, необходимой для нагревания одного моля вещества на 1 К:
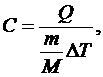
или, используя уравнение состояния идеального газа, можно рассчитать молярную теплоемкость каждого процесса по формуле
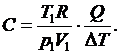
Единица молярной теплоемкости - 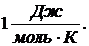
Молярная теплоемкость газа зависит от процесса с ним производимого. Для изохорного процесса соответственно можем получить
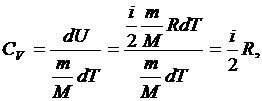
в случае изобарного процесса
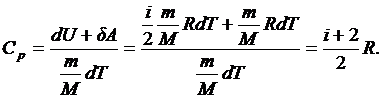
Следовательно, для γ можно получить:
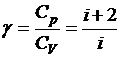 .
.
 2018-02-13
2018-02-13 673
673







