Глава 6. Алкены (олефины).
Номенклатура: Названия алкенов строятся аналогично алканам, окончание –ЕН. После окончания цифрой указывается положение двойной связи в цепи с учетом нумерации.
пример: СН3-СН=СН-СН2-СН3 пентен-2

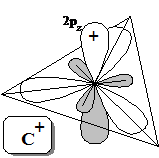
 Две связи С=С неравнозначны. Одна – σ-связь, аналогична таковой в алканах, и одна π-связь, образованная за счет бокового перекрывания не гибридизованных р-орбиталей. Молекулярные π-орбитали расположены над и под плоскостью образованной гибридными орбиталями. Длина связи С=С 1,34 Ǻ. За счет наличия π-связи в алкенах, в отличие от одинарной связи в алканах, затруднено свободное вращение относительно кратной связи С=С и кроме изомерии углеродного скелета, как в алканах, добавляется изомерия положения кратной связи и возникает один из типов пространственной изомерии – Z/E.
Две связи С=С неравнозначны. Одна – σ-связь, аналогична таковой в алканах, и одна π-связь, образованная за счет бокового перекрывания не гибридизованных р-орбиталей. Молекулярные π-орбитали расположены над и под плоскостью образованной гибридными орбиталями. Длина связи С=С 1,34 Ǻ. За счет наличия π-связи в алкенах, в отличие от одинарной связи в алканах, затруднено свободное вращение относительно кратной связи С=С и кроме изомерии углеродного скелета, как в алканах, добавляется изомерия положения кратной связи и возникает один из типов пространственной изомерии – Z/E.
В простейшем случае, при наличии двух заместителей, если заместители располагаются по одну сторону от оси двойной связи, то этот изомер называется Z (от немецкого слова zusammen - вместе), а по разные стороны – E (entgegen - напротив). Иногда, Z -изомер называют цис, а E -изомер – транс.
 В случае нескольких заместителей с каждой стороны кратной связи цис/транс обозначения уже не работают, и следует выбирать старший заместитель с каждой из сторон двойной связи. Старшинство заместителей определяют по атомной массе заместителя (метод Канна-Ингольда-Прелога) – чем выше атомная масса, тем старше заместитель (см. главу 4 «Изомерия»).
В случае нескольких заместителей с каждой стороны кратной связи цис/транс обозначения уже не работают, и следует выбирать старший заместитель с каждой из сторон двойной связи. Старшинство заместителей определяют по атомной массе заместителя (метод Канна-Ингольда-Прелога) – чем выше атомная масса, тем старше заместитель (см. главу 4 «Изомерия»).
(Е)-2-метил-5-хлоргексен-2
Методы получения:
Реакция элиминирования (Е)
 а) элиминирование галогеноводородов (X=Hal, Y=H) из алкилгалогенидов протекает под действием органических или неорганических оснований (KOH, NaOH, t-BuOK и т.п.) в неводных полярных средах (например, в спирте). Водород, как правило, уходит от того атома углерода, где образуется наиболее стабильный карбоанион. (Ранее, для определения направления элиминирования использовали правило Зайцева - “при элиминировании частицы НХ водород уходит от наименее гидрогенизованного (содержащего меньшее количество водородных заместителей) атома углерода”)
а) элиминирование галогеноводородов (X=Hal, Y=H) из алкилгалогенидов протекает под действием органических или неорганических оснований (KOH, NaOH, t-BuOK и т.п.) в неводных полярных средах (например, в спирте). Водород, как правило, уходит от того атома углерода, где образуется наиболее стабильный карбоанион. (Ранее, для определения направления элиминирования использовали правило Зайцева - “при элиминировании частицы НХ водород уходит от наименее гидрогенизованного (содержащего меньшее количество водородных заместителей) атома углерода”)
б) Элиминирование двух атомов галогенов расположенных у соседних атомов углерода (так называемых вицинальных) (X=Hal, Y=Hal) протекает под действием активных двухвалентных металлов (Zn, Mg).
в) Элиминирование воды (X=OH, Y=H) из спиртов протекает под действием водоотнимающих (дегидратирующих) средств – Al2O3 H2SO4 H3PO4. Закономерности отщепления сложные, но похожи на случай с элиминированием галогеноводородов.
Механизмы реакций элиминирования подробно будут разобраны в главе 10 «галогенпроизводные».
г) Дегидрирование насыщенных углеводородов (включая крекинг нефти) и частичное гидрирование ацетиленовых углеводородов (алкинов).
2. Реакция Виттига – образование олефинов из альдегидов и кетонов с применением илидов фосфора. Подробно эта реакция будет рассматриваться в главе 13 «карбонильные соединения».
Химические свойства алкенов в большой степени связаны с наличием в их составе кратной связи. Из данных таблиц 2 и 3 (глава 3) видно, что прочность π-связи (145-88=57 ккал/моль) меньше чем σ-связи. Поэтому многие реакции с участием олефинов протекают по механизму присоединения с разрывом π-связи и образованием двух σ-связей.
реакция электрофильного присоединения (AdE). так как богатые электронной плотностью π-орбитали удалены от оси связи и легко доступны для взаимодействия, основным типом атакующей частицы будет электрофил. Эта частица представляет собой положительно заряженный ион (катион) или положительный конец диполя.
 Реакция электрофильного присоединения AdE протекает по следующему механизму:
Реакция электрофильного присоединения AdE протекает по следующему механизму:
На первой стадии электрофильная частица образует симметричный π-комплекс с частичным перераспределением электронной плотности с π-орбитали на электрофил. Далее образуется также симметричный трехчленный ониевый ион в котором положительный заряд делокализован по трем атомам. На следующей стадии ониевый ион перегруппировывается в σ-комплекс с образованием ковалентной связи и локализации положительного заряда на атоме углерода. Последняя стадия заключается во взаимодействии полученного катиона и Y– и образованием второй ковалентной связи. Считают, что во многих случаях образование σ-комплекса не происходит и противоион Y– взаимодействует непосредственно с ониевым ионом. Это подтверждается экспериментальными данными. Показано, что в большинстве случаев присоединение частицы Y– происходит с противоположной стороны от заместителя Х (это хорошо видно в циклических соединениях), а это возможно только в случае атаки анионом непосредственно ониевого иона.
Селективность электрофильного присоединения по кратной связи обусловлена раскрытием цикла ониевого иона с образованием σ-комплекса, содержащего наиболее стабилизированный (устойчивый) карбокатион. (правило Марковникова в современном толковании). Электронное строение карбокатиона аналогично углеродному радикалу, с той только разницей, что на негибридизованной р-орбитали располагается катионный центр (формально, пустая электронная орбиталь).
 По данному механизму присоединяются галогеноводороды (X=H, Y=Hal) с образованием алкилгалогенидов, галогены(X=Y=Cl, Br) с образованием вицинальных дигалогенидов, вода (X=H, Y=OH) с образованием спиртов, спирты (X=H, Y=OR) с образованием простых эфиров и многие другие реагенты. Э лектрофильное присоединение, как правило, дает только один продукт – по правилу Марковникова.
По данному механизму присоединяются галогеноводороды (X=H, Y=Hal) с образованием алкилгалогенидов, галогены(X=Y=Cl, Br) с образованием вицинальных дигалогенидов, вода (X=H, Y=OH) с образованием спиртов, спирты (X=H, Y=OR) с образованием простых эфиров и многие другие реагенты. Э лектрофильное присоединение, как правило, дает только один продукт – по правилу Марковникова.
Следует особо отметить, что на стадиях образования ониевого иона и карбокатиона возможна атака сторонним (внешним) нуклеофилом. Так, при хлорировании олефинов в водной среде, помимо дихлорида получается хлоргидрин – продукт атаки промежуточно образующегося карбокатиона водой. Причем последний продукт преобладает, за счет высокой концентрации стороннего нуклеофила (в данном случае – воды).

Стабильность карбокатионов (как и радикалов) связана с “индуктивными (I)” и “мезомерными (M)” электронными эффектами заместителей при катионном центре. Наличие соседних групп, проявляющих положительные электронные эффекты, стабилизирует карбокатионный центр за счет подачи электронной плотности и делокализации положительного заряда. Группы, проявляющие отрицательные электронные эффекты, наоборот, дестабилизируют катионный центр.
индуктивный (I) эффект - Электронное влияние, распространяющееся по σ-связи и связанное с разницей в электроотрицательности рассматриваемого атома углерода и атома (или группы атомов) заместителя.
Примеры:
+I эффект (положительный индуктивный эффект)
 Метильная (алкильная) группа проявляет +I эффект за счет наличия незначительной поляризации связи С-Н в сторону углерода. В общем случае +I эффектом обладают все атомы имеющие меньшую электроотрицательность, чем углерод. (Прямыми стрелками указывается направление смещения электронной плотности по σ-связи). Помимо алкильных групп, положительным индуктивным эффектом обладают атомы с более низкой электроотрицательностью по сравнению с атомом углерода – B, Si, Ge и их производные, а также большинство металлов.
Метильная (алкильная) группа проявляет +I эффект за счет наличия незначительной поляризации связи С-Н в сторону углерода. В общем случае +I эффектом обладают все атомы имеющие меньшую электроотрицательность, чем углерод. (Прямыми стрелками указывается направление смещения электронной плотности по σ-связи). Помимо алкильных групп, положительным индуктивным эффектом обладают атомы с более низкой электроотрицательностью по сравнению с атомом углерода – B, Si, Ge и их производные, а также большинство металлов.
-I эффект (отрицательный индуктивный эффект)
 Отрицательный индуктивный эффект проявляют атомы с большей электроотрицательностью чем углерод.
Отрицательный индуктивный эффект проявляют атомы с большей электроотрицательностью чем углерод.
Мезомерный эффект (М) -электронное влияние распространяющееся по π-связи и в сравнении с индуктивным эффектом приблизительно на два порядка сильнее за счет большей подвижности π-облаков. Кроме того, при наличии длинной цепочки сопряженных кратных связей, мезомерный эффект практически не ослабевает с расстоянием, в отличие от индуктивного эффекта, который затухает очень быстро и заметен, максимум, в пределах двух последовательных σ-связей.
Примеры:
+М эффект -М эффект



(Изогнутой стрелкой обозначается смещение электронной плотности по π-связи.)
Реакция оксимеркурирования (AdE)
Ацетат двухвалентной ртути (Hg(OAc)2) реагирует с олефинами по механизму электрофильного присоединения. Роль электрофила в данном случае играет атом ртути. В результате реакции (после восстановления и гидролиза) региоселективно образуется предельный спирт по правилу Марковникова.

Эту реакцию часто используют для мягкой и селективной гидратации двойной связи. Если прямое введение воды затруднено, или непредельный субстрат нестабилен в условиях гидратации.
 2018-02-14
2018-02-14 1175
1175