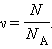При хаотическом движении молекул происходят многочисленные столкновения молекул газа друг с другом.
Расстояние, которое пролетает молекула между двумя последовательными столкновениями, называется длиной свободного пробега и обозначается λ длины свободного пробега между отдельными столкновениями молекулы могут значительно отличаться друг от друга. Поэтому пользуются средней длиной свободного пробегаλ1:
λ = (λ1+ λ2 +…+ λz) / z.
Если z обозначает среднее число столкновений молекулы за 1 сек., то
λ = υ/z.
Броуновское движение- движение мелких частиц, взвешенных в жидкости или газе, под действием не скомпенсированных ударов молекул вещества.
Диффузия- процесс выравнивания концентраций, обусловленный переносом вещества посредством молекулярного движения.
Масса и размер молекул.
Молекулы имеют чрезвычайно малые размеры. Простые одноатомные молекулы имеют размер порядка 10–10 м. Сложные многоатомные молекулы могут иметь размеры в сотни и тысячи раз больше. (1 нм = 10-9 м). Например: диаметр молекулы воды (H2O) равен 0,26 нм.
В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль).
Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C. Молекула углерода состоит из одного атома.
Таким образом, в одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NA:
| NA = 6,02·1023 моль–1. |
Постоянная Авогадро – одна из важнейших постоянных в молекулярно-кинетической теории.
Количество вещества ν определяется как отношение числа N частиц (молекул) вещества к постоянной Авогадро NA:
|
Массу одного моля вещества принято называть молярной массой M. Молярная масса равна произведению массы m0 одной молекулы данного вещества на постоянную Авогадро:
| M = NA · m0. |
Молярная масса выражается в килограммах на моль (кг/моль). Для веществ, молекулы которых состоят из одного атома, часто используется термин атомная масса.
За единицу массы атомов и молекул принимается 1/12 массы атома изотопа углерода 12C (с массовым числом 12). Она называется атомной единицей массы (а. е. м.):
| 1 а. е. м. = 1,66·10–27 кг. |
Эта величина почти совпадает с массой протона или нейтрона. Отношение массы атома или молекулы данного вещества к 1/12 массы атома углерода 12C называется относительной массой.
Закон Авогадро: в равных объемах различных газов при одинаковым давлении и температуре содержится одинаковое количество молекул.
Идеальный газ.
Идеальным считается газ, удовлетворяющий следующим условиям:
· объемом всех молекул газа можно пренебречь по сравнению с объемом сосуда, в котором этот газ находится;
· время столкновения молекул друг с другом пренебрежимо мало по сравнению со временем между двумя столкновениями;
· молекулы взаимодействуют между собой только при непосредственном столкновении;
· силы притяжения между молекулами идеального газа ничтожны малы и ими можно пренебречь;
· движение молекул подчиняется закона Ньютона.
Идеальный газ оказывает давление на стенки сосуда за счет упругих ударов его молекул о стенки.
 2018-02-14
2018-02-14 836
836