Пример № 1. Напишите структурную формулу 2,2,5,5-тетраметилгексана. Напишите формулу его изомера, имеющего в качестве заместителей при основной цепи только этильные радикалы.
Решение:
Структурная формула 2,2,5,5-тетраметилгексана:

В качестве изомера с этильными радикалами можно взять углеводород, имеющий 6 атомов углерода в главной цепи и два этильных заместителя в положениях 3 и 4, т.е. 3,4-диэтилгексан:

Пример № 2. Запишите уравнения реакций, при помощи которых можно из метана и неорганических веществ получить бутан.
Решение:
1. Хлорированием метана получают хлорметан (хлористый метил):
CH4 + Cl2 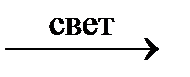 CH3Cl + HCl
CH3Cl + HCl
2. При нагревании хлорметана с натрием образуется этан (реакция Вюрца):
2CH3Cl + 2Na 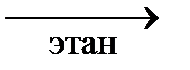 CH3 – CH3 + 2NaCl
CH3 – CH3 + 2NaCl
3. При хлорировании этана получают:
CH3 – CH3 + Cl2 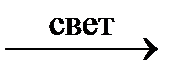
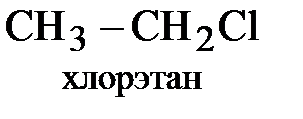 + HCl
+ HCl
4. Бутан получают из галогенпроизводного этана по реакции Вюрца:
2C2H5Cl + 2Na ® CH3 – CH2 – CH2 – CH3 + 2NaCl
Пример № 3. Рассчитайте массу тетрахлорида углерода, который можно получить при хлорировании метана объёмом 11,2 л молекулярным хлором, объём которого в реакционной смеси равен 56 л (н.у.). Выход продукта составляет 70 % от теоретически возможного.
Решение: Записываем уравнение реакции хлорирования метана до тетра-
хлорида углерода: CH4 + 4Cl2 ® CCl4 + 4HCl
Определяем количества исходных веществ:
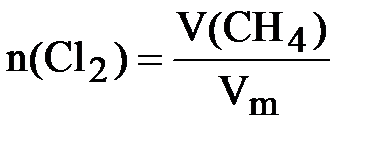 ;
; 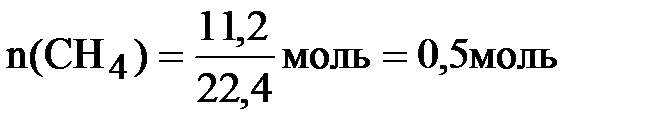
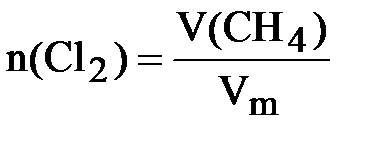 ;
; 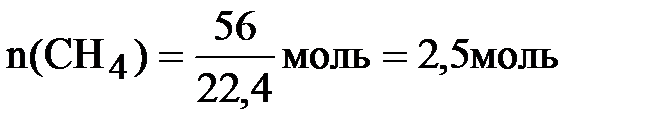
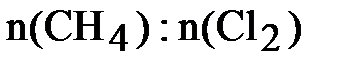 = 0,5: 2,5 = 1:5,
= 0,5: 2,5 = 1:5,
следовательно, хлор взят в избытке. Все дальнейшие расчёты проводим по метану, взятому в недостатке: 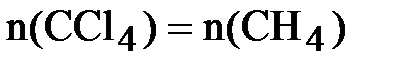 = 0,5 моль.
= 0,5 моль.
Определяем массу CCl4, который может быть получен при количественном выходе:
m(CCl4) = n(CCl4) ×M(CCl4) = 0.5 × 154 = 77 г
Учитывая, что выход продукта составляет 70 % от теоретически возможного, находим массу полученного CCl4:
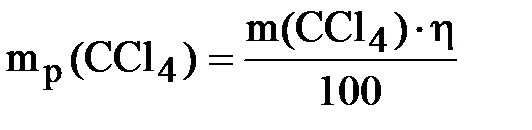 ;
; 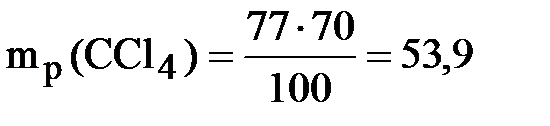 г
г
Ответ: 53,9 г.
Пример № 4. При сгорании вещества массой 4,25 г образовались оксид углерода (IV) массой 13,2 г и вода массой 5,85 г. Плотность паров вещества по воздуху равна 5,862. Определите формулу вещества.
Решение: Так как в результате горения вещества образуются СО2 и Н2О, то в состав соединения входят углерод, водород и, возможно, кислород.
1. Определяем количества (моль) оксида углерода (IV) и воды, образовавшихся в результате горения:
n(CO2) = m/M = 13,2/44 = 0,3; n(H2O)= m/M = 5,85/18 = 0,325
2. Определяем количества атомов углерода и водорода, которые содержались в исходном соединении:
n(C) = n(CO2) = 0,3 моль
n(H) = 2 ∙n(H2O) = 2 ∙ 0,325 = 0,65 моль
3. Определяем массы углерода и водорода:
m(C) = n(C).∙M(C) = 0,3 ∙ 12 = 3,6 г.
m(H) = n(H) ∙ M(H) = 0,65 г
4. Суммарная масса углерода и водорода:
m(C) + m(H) = 3,6 + 0,65 = 4,25 г,
т.е. равна массе исходного вещества, следовательно, вещество не содержит кислорода (является углеводородом состава СхНу).
5. Определяем соотношение углерода и водорода:
n(C).: n(H) = 0,3: 0,65
6. Определяем молярную массу вещества:
М(СхНу) = 29.Dвозд. = 29 ∙ 5,862 = 170 г/моль
Молярную массу можно представить в виде:
М(СхНу) = 12х + у = 170.
7. Решаем систему уравнений:
n(C): n(H) = 0,3:0,65
М(СхНу) = 12х + у = 170
Находим, что х = 12, а у = 26. Формула углеводорода С12Н26.
Пример № 5. Определить формулу вещества, если оно содержит 84,21 % углерода и 15,79 % водорода, и имеет относительную плотность по воздуху, равную 3,93.
Решение: 1. Пусть масса вещества равна 100 г. Тогда масса С будет равна 84,21 г, а масса H - 15,79 г.
2. Найдём количество вещества каждого атома:
n(C) = m / M = 84,21 / 12 = 7,0175 моль,
n(H) = 15,79 / 1 = 15,79 моль.
3. Определяем мольное соотношение атомов С и H:
С: Н = 7,0175: 15,79 (сократим оба числа на меньшее) = 1: 2,25 (домножим на 4) = 4: 9.
Таким образом, простейшая формула – С4Н9.
4. По относительной плотности рассчитаем молярную массу:
М = D(возд.) ∙ 29 = 114 г/моль.
6. Молярная масса, соответствующая простейшей формуле С4Н9 равна
57 г/моль, это в 2 раза меньше истинно молярной массы.
Значит, истинная формула – С8Н18.
Пример № 6. 448 мл (н. у.) газообразного предельного нециклического углеводорода сожгли, и продукты реакции пропустили через избыток известковой воды, при этом образовалось 8 г осадка. Какой углеводород был взят?
Решение: Общая формула газообразного предельного нециклического углеводорода (алкана) — CnH2n+2.
Тогда схема реакции сгорания выглядит так:
CnH2n+2 + О2 → CO2 + H2O
Нетрудно заметить, что при сгорании 1 моль алкана выделится n моль углекислого газа.
Количество вещества алкана находим по его объёму (не забудьте перевести миллилитры в литры!):
ν(CnH2n+2) = 0,488 / 22,4 = 0,02 моль.
1. При пропускании углекислого газа через известковую воду Са(ОН)2 выпадает осадок карбоната кальция:
СО2 + Са(ОН)2 = СаСО3 + Н2О
Масса осадка карбоната кальция − 8 г, молярная масса карбоната кальция 100 г/моль. Значит, его количество вещества
ν(СаСО3) = 8 / 100 = 0,08 моль.
Количество вещества углекислого газа тоже 0,08 моль.
2. Количество углекислого газа в 4 раза больше чем алкана, значит формула алкана − С4Н10.
Этой формуле соответствуют два изомера – н-бутан и 2-метилпропан:

Ответ: общая формула алкана − С4Н10
Пример № 7. Углеводород имеет элементный состав: 82,76 % углерода и 17,24 % водорода (по массе). При хлорировании (радикальном) углеводород образует два изомерных монохлорида − первичный и третичный. Определите строение исходного углеводорода.
Решение: Пусть формула углеводорода − СхНу (М = 12x+y). Массовая доля водорода в одном моле этого вещества равна: w(H) = y/(12x+y) = 0,1724, откуда, y = 2,5x. Это означает, что простейшая формула углеводорода С2Н6.
Ей соответствует истинная формула С4Н10. Существует два углеводорода состава С4Н10:

Третичные атомы углерода есть только в одном из этих двух изомеров, в 2-метилпропане, поэтому только 2-метилпропан при хлорировании может образовать третичный алкилхлорид:

Ответ: 2-метилпропан.
Пример № 8. Газ, образующийся при полном сгорании 0,1 моль предельного углеводорода, пропустили через избыток известковой воды, при этом выпало 60 г осадка. Определите молекулярную формулу и строение предельного углеводорода, если известно, что он содержит один четвертичный атом углерода.
Решение: При сгорании одного моля углеводорода, содержащего n атомов углерода, образуется n моль СО2:
СnН2n+2 + (3n+1)/2O2 → СO2 + (n+1)Н2О
При пропускании СО2 через известковую воду образуется карбонат кальция:
Са(ОН)2 + СО2 = СаСО3 + Н2О; v(СаСО3) = 60/100 = 0,6 моль = n(CO2).
При сгорании 0,1 моль СnН2n+2 выделилось 0,6 моль СО2, следовательно
n = 6. Молекулярная формула углеводорода - С6Н14.
Из пяти углеводородов состава С6Н14 четвертичный атом углерода есть только в 2,2-диметилбутане:

Пример № 9. При пропускании 11,2 л смеси метана, оксида углерода (IV) и оксида углерода (II) через раствор гидроксида натрия, взятый в избытке, объём исходной смеси уменьшился на 4,48 л (н.у.). Для полного сгорания оставшейся смеси потребовалось 6,72 л (н.у.) кислорода. Определите состав исходной смеси (в % по объёму).
Решение: При пропускании смеси через раствор щёлочи поглощается только оксид углерода (IV): СО2 + 2NaOH = Na2CO3 + Н2О
Объём поглощенного СО2 составляет 4,48 л.
Следовательно, n(CO2) = 4,48/22,4 = 0,2 моль. После поглощения CO2 объём смеси составил 11,2−4,48 = 6,72 л, что соответствует 0,3 моль. Оставшиеся газы сгорают по уравнениям:
СН4 + 2О2 = СО2 + 2Н2О; 2СО + О2 = 2СО2
Пусть в смеси было x моль СН4 и у моль СО, тогда на сгорание СН4
израсходовано 2x моль О2, а на сгорание СО − у/2 моль O2; всего израсходовано 6,72/22,4 = 0,3 моль О2. Имеем систему:
x + у = 0,32
2x + у/2 = 0,3;
Отсюда x = 0,1, у = 0,2. Значит, в исходной смеси было 0,1 моль СН4 (2,24 л, или 20 %), 0,2 моль СО (4,48 л, или 40 %) и 0,2 моль СO2 (4,48 л, или 40 %).
Ответ: 20 % СН4; 40 % СО; 40 % СО2
 2018-02-14
2018-02-14 2674
2674
