Фоторецепторные молекулы воспринимают в качестве сигнала квант света. Тем не менее, принципы передачи сигнала через мембрану у фоторецепторов и рецепторов гормонов весьма сходны.
Зрительный родопсин локализован у большинства позвоночных в специализированных фоторецепторных клетках двух типов – палочках и колбочках, которые выстилают внутреннюю сторону сетчатки глаза (рис. 70).
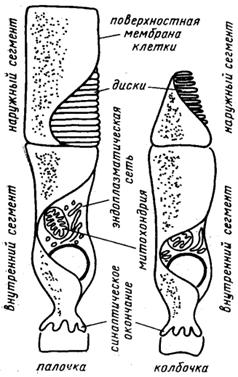
Рис. 70. Строение палочки и колбочки
Палочки функционируют в условиях слабого освещения. Они очень чувствительны к световым сигналам и при сильном освещении десенсибилизируются. При ярком свете зрительный процесс обеспечивается колбочками. По-видимому, именно колбочки отвечают за объемное изображение, реагируют на перемещение предметов. Колбочки передают цветовую гамму изображения[A67].
В колбочках содержатся пигменты, поглощающие в различных областях спектра.
У человека различают три вида колбочек, поглощающих свет в коротковолновой, средней и длинноволновой областях видимого спектра.
Именно эти различия в свойствах пигментов колбочек лежат в основе цветового зрения. При слабом освещении колбочки не принимают сигнала, и глаз не воспринимает цвет объектов.
Рецепторная мембрана палочек состоит из замкнутых дисков, не соприкасающихся с цитоплазматической мембраной, в то время как в колбочках она образует систему складок. Таким образом, для передачи сигнала в палочках от диска к плазматической мембране необходим гидрофильный посредник. Как палочки, так и колбочки условно делят на два сегмента: наружный и внутренний. Наружный сегмент содержит фоторецепторные мембраны, а внутренний – специализируется на генерации энергии и содержит аппарат, синтезирующий молекулы вторичных посредников, участвующих в передаче сигнала. Из внутреннего сегмента формируется синаптическое окончание, осуществляющее передачу сигнала к нервным волокнам. Наружный сегмент легко отделяется от внутреннего при мягкой гомогенизации мембран, что позволяет с помощью дифференциального центрифугирования выделять фоторецепторные мембраны в чистом виде[A68].
Зрительный родопсин (как и бактериородопсин), содержит в активном центре 11-цис-ретиналь. Белковая часть родопсина без ретиналя называется опсином и функционирует как фермент. Первичные структуры зрительного родопсина и бактериородопсина различны. Полипептидная цепь родопсина состоит из 348 аминокислот. К молекуле белка присоединены две олигосахаридные цепи, присоединенные к остаткам аспарагина в положении 2 и 15. Как и у бактериородопсина, молекула зрительного родопсина пересекает мембрану 7 раз, используя участки первичной структуры, состоящих из гидрофобных аминокислот. Между собою они соединены короткими цепями гидрофильных аминокислотных последовательностей. Ретиналь расположен ближе к С-концу белка. Пигменты из колбочек сетчатки глаза человека, условно названные по области поглощаемого ими света «красный», «голубой» и «зеленый», обнаруживают в своей структуре чередование гидрофобных и гидрофильных участков, при этом «красный» и «зеленый» пигменты обладают высокой степенью гомологии с родопсином из палочек, а «голубой» значительно отличается от него. Бактериородопсин и родопсин из палочек сетчатки практически не имеют гомологичных участков, однако они формируют сходные структуры в мембране, состоящие в каждом случае из 7 гидрофобных колонн. Вряд ли эти два пигмента имеют либо прямую эволюционную связь. По-видимому, упаковка молекулы ретиналя в 7 α-спиральных колонн является оптимальным способом обеспечения его функционирования в мембране в качестве первичного акцептора кванта света. Родопсин обладает характерным спектром поглощения в областях 280 и 500 нм (рис. 71).
В основе функционирования как родопсина, так и бактериородопсина лежит светозависимая изомеризация ретиналя. При поглощении кванта света 11-цис-ретиналь родопсина переходит полностью в транс-форму. Эта изомеризация запускает каскад реакций, сопровождающихся изменением спектра поглощения молекулы родопсина[A69].

Рис. 71. Спектр поглощения зрительного родопсина
Таким образом, в результате поглощения фотона родопсином происходит образование опсина и свободного ретиналя. Другой результат этого процесса – гиперполяризация мембраны палочек.
В норме на мембране палочек регистрируется так называемый «темновой ток», обеспечиваемый входом в клетку натрия и выходом калия за счет работы Nа/К-АТ-Фазы (см. раздел 6.4.1).
Трансмембранный потенциал при этом составляет 20 мВ. Вспышка света вызывает гиперполяризацию мембраны до 70 мВ. При этом ее величина пропорциональна интенсивности освещения.
Гиперполяризация мембран измеряется с помощью микроэлектродной техники и может быть создана в эксперименте приложением потенциала к самой мембране. С помощью этого метода было доказано, что гиперполяризация мембраны палочки является необходимым и достаточным условием передачи светового сигнала через синапсы к зрительным нейронам.
Таким образом, поглощение кванта света ретиналем родопсина, локализованным в диске, должно привести к гиперполяризации плазматической мембраны палочек, непосредственно не связанной с мембраной фоторецепторного диска. Наличие вторичного мессенджера (цГМФ) предполагало участие специального белка-посредника между ГТФ и родопсином, регулирующего процесс образования цГМФ. Этот белок был назван трансдуцином, так как он участвует в трансдукции (преобразовании) светового сигнала в электрический. Оказалось, что трансдуцин состоит из трех субъединиц – α, β и γ, способных к обратимой диссоциации[A70].
Активированная светом молекула родопсина – метародопсин-II – образует специфический комплекс с трансдуцином, находящимся в комплексе с ГДФ, которая связывается с α-субединицей трансдуцина (рис. 72).
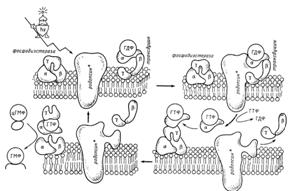
Рис. 72. Механизм функционирования зрительного родопсина
Взаимодействие родопсина с трансдуцином катализирует обмен на α-субъединице ГДФ на ГТФ. После этого комплекс трансдуцина с родопсином диссоциирует, и практически одновременно происходит диссоциация трансдуцина на α-субъединицу, связанную с ГТФ, и на комплекс, состоящий из β- и γ-субъединиц. α-субъединица трансдуцина в ГТФ-связанной форме активирует цГМФ-зависимую фосфодиэстеразу. Этот фермент имеет аналогичное строение (состоит из трех субъединиц, α, β и γ). Ингибирование осуществляется за счет связывания связанной с ГТФ αсубъединицы с γ-субъединицей фосфодиэстеразы. При этом γсубъединица отделяется, а свободные α- и β-субъединицы осуществляют гидролиз ГТФ. Этот процесс протекает с очень большой скоростью (до 4000 молекул в секунду).
Активирующее влияние трансдуцина на фосфодиэстеразу прекращается после гидролиза ГТФ. В дальнейшем комплекс β- и γсубъединиц трансдуцина ассоциирует с ГДФ-связанной формой αсубъединицы, и молекула трансдуцина снова приобретает способность взаимодействовать с фотоактивированным родопсином ивесь цикл повторяется.
В результате активации одной молекулы родопсина образуется несколько сотен активных комплексов α-субъединицы трансдуцина с ГТФ. Это первая стадия усиления. Затем α-субъединица активирует фосфодиэстеразу. На этой стадии усиления сигнала нет, так как каждой субъединицей активируется только одна молекула фосфодиэстеразы. Затем комплекс α-субъединицы с фосфодиэстеразой (который не диссоциирует, пока не пройдет гидролиз ГТФ) осуществляет превращение нескольких тысяч молекул цГМФ. В этот период происходит более чем тысячекратное усиление. Далее механизм усиления работает на мембранном уровне, регулируя натриевые каналы и генерируя электрический импульс. Подробное описание участия трансдуцина в передаче зрительного сигнала обнаруживает до малых[A71] подробностей участие G-белков в образовании вторичных мессенджеров (см. ниже) Трансдуцин играет ключевую роль не только в активации, но и в инактивации сигнала. Включение и выключение сигнала осуществляются через α-субъединицу.
При этом ключевой стадией управления является гидролиз ГТФ до ГДФ. Реакции, ведущие к активации процесса, энергетически выгодны. Некоторые реакции инактивации требуют дополнительной энергии.
Родопсин инактивируется с помощью специальной протеинкиназы. Этот фермент присоединяет фосфатные группы к нескольким аминокислотам на одном конце полипептидной цепи опсина.
Затем родопсин образует комплекс с белком, называемым арестином, который блокирует связывание трансдуцина и возвращает систему в исходное «темновое» состояние.
Несмотря на то, что механизм передачи сигнала от фоторецепторного диска к плазматической мембране изучен достаточно подробно, ряд вопросов остается не выясненным. Во-первых, не вполне понятна роль ионов кальция. В некоторых работах[A72] было показано, что светозависимое увеличение концентрации внутриклеточного кальция приводит к гиперполяризации мембраны, которая исчезает после удаления ионов Са. При этом хелатирующих Са2+ агентов, снижает чувствительность фоторецепторной клетки к свету.
В последнее время активно обсуждается роль фосфоинозитидных мессенджеров в передаче сигнала в фоторецепторной клетке.
Показано, что однократное освещение приводит к активации фосфоинозитидного цикла. Было показано, что освещение палочек активирует фосфолипазу А2, и этот процесс зависит от трансдуцина, так как ингибируется коклюшным токсином. По-видимому, фосфоинозитидный цикл также участвует в передаче сигнала в фоторецепторной клетке, однако механизмы этого участия еще предстоит исследовать.
Функционирование родопсина в фоторецепторных дисках существенно зависит от липидного окружения. В фоторецепторной мембране низко содержание холестерина, а основные фосфолипиды, входящие в ее состав (фосфатидилхолин – 40%, фосфатидилэтаноламин – 38%, фосфатидилсерин – 13%), содержат подавляяющее количество полиненасыщенных жирных кислот (до 90%). Такой состав мембраны, по-видимому, обеспечивает высокую степень жидкостности мембраны, необходимую для функционирова- ния родопсина. В то же время, большое количество Полиненасыщенных жирных кислот делает фосфолипиды сетчатки уязвимыми для окислительного повреждения (см. предыдущую главу).
Механизмы работы фоторецепторов и рецепторов гормонов во многом подобны (см. рис. 65). Связывание гормона с рецептором приводит к активации G-белка, а возбуждение родопсина квантом света – к активации трансдуцина (рис. 73).

Рис. 73. Сравнение путей передачи гормонального и зрительного сигнала[A73]
Как активация G-белка, так и активация трансдуцина включают связывание ГТФ α-субъединицей. G-белок активирует аденилатциклазу (АЦ), а трансдуцин – фосфодиэстеразу (ФДЭ). Оба этих фермента осуществляют свои функции через циклические нуклеотиды. цАМФ участвует в регуляции ферментов – эффекторов гормонов, а цГМФ индуцирует открывание натриевого канала в плазматической мембране фоторецепторной клетки[A74].
Аналогия в передаче сигнала в фоторецепторной клетке с передачей гормонального сигнала усиливается тем, что трансдуцин и G-белок имеют не только общие функции, но и общую структуру.
Все исследованные к настоящему времени белки этой группы имеют идентичные β-субъединицы, а α-субъединица выполняет сходные функции. Исследование первичной структуры трансдуцина и трех G-белков из различных клеток выявило, что более 50% их полипептидных цепей практически гомологичны.
При этом в составе α-субъединиц как трансдуцина, так и G-белков имеются как консервативные мотивы, так и мотивы, возникающие в ходе эволюции. И G-белки, и трансдуцин имеют три центра связывания: для рецептора, для гуаниловых нуклеотиодов для белка-эффектора (аденилатциклазы для комплекса гормон-рецептор и фосфодиэстеразы в случае трансдуцина). Наиболее консервативными последовательностями аминокислот обладают центры связывания гуаниловых нуклеотидов.
Интересно, что участки связывания гуаниловых нуклеотидов в G-белках и трансдуцине оказались гомологичны областями связывания ГТФ в белке совершенно другого класса, в так называемом факторе элонгации. Этот фактор участвует в синтезе белка, образует комплекс цГМФ с молекулами аминоацил-тРНК и обеспечивая доставку аминокислот к месту удлинения полипептидной цепи. Цикл функционирования этого белка похож на цикл G-белков и трансдуцина – в основе его лежит механизм расщепления связанного в активном центре цГМФ. Возможно, что фактор элонгации является эволюционным предком трансдуцина и G-белков. Если это так, мы имеем еще одно подтверждение единства путей биохимической эволюции. Однажды найденный природой механизм используется для решения многих сходных задач.
 2018-02-14
2018-02-14 1334
1334








