Мытье хромовой смесью. Очень часто в лабораториях для мытья посуды применяют хромовую смесь, так как соли хрома (III) в кислом растворе являются сильными окислителями. Для приготовления хромовой смеси в концентрированную серную кислоту добавляют около 5% (от массы серной кислоты) размельченного в порошок кристаллического бихромата калия и осторожно нагревают в фарфоровой чашке на водяной бане до растворения его.
Для приготовления хромовой смеси можно применять также бихромата натрия, который растворяют в воде, а затем в раствор осторожно добавляют серную кислоту.
Смесь готовят из расчета:
Вода..............................................100 мл
Бихромат натрия.................................... 6 г
Серная кислота, d420= 1,84............................ 100 мл
При мытье хромовой смесью посуду споласкивают сначала водой, а потом наливают слегка подогретую хромовую смесь до 1/3 – 1/4 объема сосуда и осторожно и медленно смачивают внутренние стенки его. После этого хромовую смесь выливают обратно в тот же сосуд, в котором она хранится, причем стараются смочить ею оставшиеся не смоченными стенки посуды и особенно наиболее загрязненные ее края. Слив всю жидкость, посуду оставляют постоять несколько минут, затем ее моют сначала водопроводной водой (лучше теплой), потом дистиллированной.
Сильно загрязненную посуду моют хромовой смесью несколько раз.
Труднее всего отмываются загрязнения на горлышках колб. Чтобы отмыть их, хромовую смесь наливают в стакан, опускают в него горло колбы, слегка обогретой (достаточно нагревания рукой), после того как колба охладится, жидкость несколько поднимается внутрь ее. Через одну - две минуты колбу вынимают, дают стечь хромовой смеси, а затем колбу моют водой, как описано выше.
Хромовая смесь служит довольно долго. После длительного употребления ее цвет из темно-оранжевого переходит в темно-зеленый, что служит признаком ее дальнейшей непригодности для мытья. В лаборатории всегда должен быть запас хромовой смеси.[1]
Хромовая смесь очень сильно действует на кожу и одежду, поэтому обращаться с ней следует осторожно.
Неопытные работники при мытье пипеток и трубок часто набирают хромовую смесь в них ртом. При этом случается, что хромовая смесь засасывается. в рот, вызывая ожоги полости рта и порчу зубов. Хромовую смесь следует набирать в пипетку при помощи резиновой груши без баллона (рис. 1). К груше присоединяют резиновую трубку, конец которой надевают на пипетку.
Сжав рукой грушу, чтобы удалить из нее воздух, и закрыв большим пальцем отверстие для поступления воздуха, пипетку опускают в хромовую смесь. Постепенно разжимают руку (большой палец с отверстия не снимать), внутри пипетки образуется разрежение и хромовая смесь поднимается в нее. Набрав полную пипетку и продержав в ней хромовую смесь 1—2 мин, отнимают большой палец от отверстия груши и дают жидкости стечь.

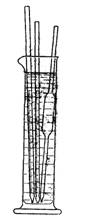
Рис. 1. Резиновая груша, Рис. 2. Мытье пипеток, бюреток
надетая на пипетку. и трубок в толстостенном цилиндре.
Повторив несколько раз эту операцию, пипетку моют, как обычно.
Пипетки, бюретки и подобные им длинные трубки удобно также мыть хромовой смесью в толстостенном цилиндре такой высоты, чтобы трубки могли быть погружены в него более чем на половину. В цилиндр помещают подлежащие мытью трубки и заливают его почти доверху хромовой смесью. Через некоторое время трубки вынимают и помещают их в цилиндр обратными концами (рис. 2).
В качестве моющего средства можно применять также раствор К2Сг2О7 в концентрированной НNO3. Для приготовления этого раствора 200 г К2Сг2О7 растворяют в 1 л НNO3. Такой раствор даже при комнатной температуре по своим моющим свойствам превосходит хромовую смесь и устойчив в течение длительного времени.
Хромовую смесь не применяют, если посуда загрязнена парафином, керосином, песком, минеральными маслами и вообще продуктами перегонки нефти. В этих случаях посуду моют паром или органическими растворителями.
Нужно избегать попадания в хромовую смесь спиртов — этилового или метилового, тотчас окисляющихся и восстанавливающих Сr2O2-7 -ион до Сг3+. В результате этого раствор приобретает зеленую окраску и делается непригодным для дальнейшего применения.
Если посуда загрязнена солями бария, мыть ее хромовой смесью, содержащей серную кислоту, нельзя, так как получающийся сернокислый барий образует на стенках посуды трудно удаляемый осадок.
Нужно заметить, что хромовую смесь полезно применять слегка подогретой (до 45—500С), тогда она действует сильнее.
Подогреть хромовую смесь можно по-разному:
1) отлив некоторое количество хромовой смеси в колбу, подогревают на горячей водной бане;
2) осторожно добавляют в хромовую смесь немного воды и концентрированной серной кислоты;
З) можно также отмываемый предмет предварительно сполоснуть горячей водой.
Если хромовая смесь попадает на кожу рук или одежду, их следует прежде всего обмыть большим количеством воды, затем раствором соды (гидрокарбоната натрия) или аммиака.
Мытье перманганатом калия. Хорошим средством для мытья посуды является 4%-ный раствор перманганат калия.
Раствор перманганата калия — сильный окислитель, особенно когда он подогрет и подкислен серной кислотой; его наливают в посуду, которую нужно предварительно вымыть горячей водой и вычистить ершом или щёткой. Затем тонкой струей добавляют немного концентрированной серной кислоты, что вызывает разогревание, вполне достаточное, чтобы все загрязнения на стенках быстро окислились. Серную кислоту следует брать в таком количестве, чтобы после добавления ее температура раствора была около 50—60°С. Обычно на 100 мл раствора перманганата калия бывает достаточно добавить 3—5 мл концентрированной серной кислоты.
Нужно брать именно серную кислоту и ни в каком случае не соляную, так как последняя окисляется перманганатом калия с образованием свободного хлора.
Иногда после мытья посуды раствором перманганата калия на стенках ее появляется бурый налет; его можно удалить, споласкивая посуду 5%-ным раствором гидросульфата натрия (NaHSО4), растворами сульфата железа (II) (FеSO4), соли Мора или органических кислот, лучше всего щавелевой. После этого посуду моют водой.
При работе с подкисленным раствором перманганата калия следует придерживаться тех же приемов мытья и мер предосторожности, которые описаны выше для хромовой смеси.
Отработанный подкисленный раствор перманганата калия обычно выливают и повторно не используют. Если же применялся неподкисленный раствор, его можно использовать несколько раз.
Подкисленным раствором перманганата калия очень хорошо очищаются ртутные насосы, трубки барометров и пр.
Иногда можно применять раствор перманганата калия, в который добавляют какую-нибудь щелочь. Такой раствор является более мягким окислителем, и после мытья им стенки посуды покрываются бурым налетом двуокиси марганца, удаление которого проводится одним из приемов, описанных выше.
Мытье смесью соляной кислоты и перекиси водорода. Очень удобным и доступным окислителем, который с успехом можно применять для мытья химической посуды, является смесь Комаровского, состоящая из равных объемов 6 н. раствора НСl и 5—6%-ного раствора перекиси водорода. Эта смесь действует очень энергично, особенно при небольшом подогревании, при этом она не влияет на стекло, чего нельзя сказать о хромовой смеси или подкисленном растворе перманганата калия. Вместо соляной кислоты можно пользоваться и уксусной.
Для мытья смесь наливают в слегка подогретую посуду (мерную посуду нагревать нельзя) или же подогревают смесь до 30—40°С. Обмывают стенки посуды смесью, затем выливают ее в ту же посуду, в которой она хранилась, для повторного использования. После этого посуду моют водой, как обычно.
Мытье серной кислотой и растворами щелочей. Когда посуда загрязнена смолистыми веществами, нерастворимыми в воде, а также в тех случаях, когда в лаборатории нет хромовой смеси, посуду можно мыть концентрированной серной кислотой или концентрированным (40%) раствором щелочи (NаОН, КОН). Смолы большей частью растворяются или в кислоте, или в щелочи[2]. Загрязненный сосуд заполняют на 1/4 щелочью (если смолы много, жидкость наливают так, чтобы вся смола была покрыта ею, но сосуд можно было бы свободно встряхивать). Когда смолы много, операцию повторяют несколько раз.
Продолжительность обработки кислотой или щелочью зависит от особенностей смолы. В одних случаях смолы можно удалить, встряхивая колбу в течение 5—10 мин, в других же случаях приходится отмывать смолу в течение нескольких часов, периодически встряхивая колбу.[3]
Обращаться с концентрированными серной кислотой и щелочью нужно осторожно; кислоту нельзя выливать в раковину. Загрязненную смолой серную кислоту или щелочь следует сливать в глиняные или стеклянные банки, которые всегда должны стоять около водопроводной раковины. Сливать в одну банку кислоту и щелочь нельзя, так как при этом будет происходить нейтрализация, сопровождающаяся сильным разогреванием, вследствие чего содержимое банки может разбрызгиваться.
Кроме растворов гидроксида натрия или калия, полезно пользоваться и менее сильными щелочами, например гидроксидом кальция, что, в частности, очень удобно для мытья посуды, загрязненной керосином. Для этого в посуду наливают раствор (5—10%) гидроксида кальция и энергично встряхивают. Повторяя операцию два-три раза, очищают посуду от следов керосина. Гидроксида кальция много брать не следует. На колбу емкостью 1 л достаточно взять 100—200 мл.
После обработки гидроксидом кальция посуду моют теплой водой.
Специальные методы очистки веществ
Разделение и очистка веществ являются операциями, обычно связанными между собой. Разделение смеси на составляющие чаще всего преследует цель получения чистых, по возможности без примесей, веществ. Однако само понятие о том, какое вещество следует считать чистым, еще окончательно не установлено, так как требования к чистоте вещества меняются. В настоящее время методы получения химически чистых веществ приобрели особое значение.
Разделение и очистка веществ от примесей основываются на использовании их определенных физических, физико-химических или химических свойств.
Техника важнейших методов разделения и очистки веществ (перегонка и сублимация, экстракция, кристаллизация и перекристаллизация, высаливание) описана в соответствующих главах. Это – наиболее распространенные приемы, чаще всего используемые не только в лабораторной практике, но и в технике.
В отдельных наиболее сложных случаях используют специальные методы очистки.
Диализ может быть использован для разделения и очистки веществ, растворенных в воде или в органическом растворителе. Этим приемом чаще всего пользуются для очистки высокомолекулярных веществ, растворенных в воде, от примесей низкомолекулярных или от неорганических солей.
Для очистки методом диализа необходимы так называемые полупроницаемые перегородки, или мембраны. Особенность их заключается в том, что они имеют поры, позволяющие проходить через них веществам, размер молекул или ионов которых меньше размеров пор.
Кристаллизация
ОБЩИЕ ПОНЯТИЯ
При охлаждении горячего насыщенного раствора из него выделяется растворенное вещество, и чем ниже температура, до которой охлаждают раствор, тем большее количество кристаллов выпадает в осадок.
Жидкость, которую после этого можно отделить от осадка фильтрованием (так называемый маточный раствор), будет все же насыщенным при данной температуре раствором, из которого можно дополнительно выделить некоторое количество растворенного вещества или при более сильном охлаждении, или путем упаривания, т. е. удаляя некоторую часть растворителя.
Если в растворе находится не одно, а несколько различных веществ, то они могут быть разделены так называемой дробной кристаллизацией. Возможность такого разделения объясняется неодинаковой растворимостью веществ при различных температурах. При некоторой определенной температуре раствор будет насыщенным в отношении одного и ненасыщенным в отношении другого вещества. Естественно, что в то время как первое вещество станет при охлаждении выпадать в осадок, второе еще будет полностью находиться в растворе.
Указанные соображения положены в основу метода очистки кристаллических веществ путем кристаллизации.
 2018-02-13
2018-02-13 3826
3826








