Триметилгептан
Из таблицы Бенсона возьмем парциальные вклады для 
 и
и  , вводим набор поправок:
, вводим набор поправок:
поправки на гош взаимодействие
R=C6H13
R1=C2H5, R2=C3H7
Вводим 7 поправок «алкил-алкил»
Поправка на симметрию:
 ,
, 
Поправка на смешение конформеров:

Таблица 1
| Кол-во вкладов | Вклад | Вклад в энтальпию, кДж/моль | Вклад | Вклад в энтропию Дж/К*моль | Вклад | Вклад в т/емкость Дж/К*моль | |
| СН3-(С) | 5 | -42.19 | -210.95 | 127.29 | 636.45 | 25.910 | 129.55 |
| СН-(3С) | 1 | -7.95 | -7.95 | -50.52 | -50.52 | 19.000 | 19 |
| С-(4С) | 1 | 2.09 | 2.09 | -146.92 | -146.92 | 18.29 | 18.29 |
| СН2-(2С) | 3 | -20.64 | -61.92 | 39.43 | 118.29 | 23.02 | 69.06 |
| ∑ | 10 |
| -278.73 |
| 557.3 |
| 235.9 |
| гош-поправка | 7 | 3.35 | 23.45 | для вкладов в энтропию и теплоемкость для данной поправки в справочке не приведены значения | |||
| поправка на симм. | σнар=1 | σвнутр=243 | -45.669 | ||||
| попр. на смешение | N= | 1 | 5.76 | ||||
| ΔHo | -255.28 | ΔSo | 517.391 | ΔСpo | 235.9 | ||
Рассчитаем для этого соединения энтальпию и энтропию образования методом Татевского по связям по первому уровню приближения.
| Кол-во вкладов | Парц. вклад, кДж/моль | Вклад в энтальпию кДж/моль | Парц. вклад, Дж/К*моль | Вклад в энтропию Дж/К*моль | |
| (С1-С2)1 | 2 | -52,581 | -105,162 | 147,74 | 295,48 |
| (С1-С3)1 | 1 | -45,286 | -45,286 | 111,08 | 111,08 |
| (С1-С4)1 | 2 | -41,286 | -82,572 | 92,46 | 184,92 |
| (С2-С3)1 | 2 | -10,686 | -21,372 | 0,41 | 0,82 |
| (С3-С4)1 | 2 | 13,362 | 26,724 | -63,04 | -126,08 |
| ∑ | 9 | -227,668 | 466,22 | ||
|
|
| ΔHo | -227,668 | ΔSo | 466,220 |
Циклогексан
Из таблицы Бенсона возьмем парциальные вклады для 
 и
и  , вводим набор поправок: Поправки на гош – взаимодействие отсутствуют.
, вводим набор поправок: Поправки на гош – взаимодействие отсутствуют.
Вводим поправку на циклогексановый цикл.
Таблица 2
| Кол-во вкладов | Вклад | Вклад в энтальпию, кДж/моль | Вклад | Вклад в энтропию Дж/К*моль | Вклад | Вклад в т/емкость Дж/К*моль | |
| СН2-(2С) | 6 | -20.64 | -123.84 | 39.43 | 236.58 | 23.02 | 138.12 |
| поправка на цикл | 1 | 78.69 | 78.69 | -24.28 | -24.28 | ||
| ∑ | 6 | -123.84 | 315.27 | 113.84 | |||
| ΔHo | -123.84 | So | 315.270 | Сpo | 113.840 |
Рассчитаем для этого соединения энтальпию и энтропию образования методом Татевского по связям по первому уровню приближения.
|
| Кол-во вкладов | Парц. вклад, кДж/моль | Вклад в энтальпиюкДж/моль | Парц. вклад, Дж/К*моль | Вклад в энтропию Дж/К*моль |
| (С2-С2)1 | 6 | -20,628 | -123,768 | 39,03 | 234,18 |
| ∑ | 6 | -123,768 | 234,18 | ||
| поправка на цикл |
|
|
|
| 76,89 |
| ΔHo | -123,768 | ΔSo | 311,070 |
Этилнонаноат
Из таблицы Бенсона возьмем парциальные вклады для 
 и
и  , вводим набор поправок.
, вводим набор поправок.
Поправки на гош – взаимодействие:
Вводим 1 поправку «алкил-алкил». Поправка на внутреннюю симметрию:  .
.

Таблица 3
| Кол-во вкла-дов | Вклад | Вклад в энтальпию, кДж/моль | Вклад | Вклад в энтропию Дж/К*моль | Вклад | Вклад в т/емкость Дж/К*моль | ||
| СН3-(С) | 2 | -42.19 | -84.38 | 127.29 | 254.58 | 25.91 | 51.82 | |
| О-(С,С0) | 1 | -180.41 | -180.41 | 35.12 | 35.12 | 11.64 | 11.64 | |
| СН2-(С,О) | 1 | -33.91 | -33.91 | 41.02 | 41.02 | 20.89 | 20.89 | |
| СО-(С,О) | 1 | -146.86 | -146.86 | 20 | 20 | 24.98 | 24.98 | |
| СН2-(2С) | 6 | -20.64 | -123.84 | 39.43 | 236.58 | 23.02 | 138.12 | |
| СН2-(С,СО) | 1 | -21.77 | -21.77 | 40.18 | 40.18 | 25.95 | 25.95 | |
| ∑ | 12 | -591.17 | 627.48 | 273.4 | ||||
| поправка на симм. | σнар=1 | σвнутр=9 | -18.268 | |||||
| ΔHo | -591.17 | So | 609.212 | Сpo | 273.400 | |||
Орто-Толуидин
Из таблицы Бенсона возьмем парциальные вклады для 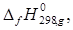
 и
и  , вводим набор поправок. Поправка на симметрию:
, вводим набор поправок. Поправка на симметрию:


Введем поправку на орто-взаимодействие типа «полярный/неполярный»
Таблица 4
| Кол-во вкла-дов | Вклад | Вклад в энтальпию, кДж/моль | Вклад | Вклад в энтропию Дж/К*моль | Вклад | Вклад в т/емкость Дж/К*моль | |
| СН3-(Сb) | 1 | -42.19 | -42.19 | 127.29 | 127.29 | 13.56 | 13.56 |
| NН2-(Сb) | 1 | 20.09 | 20.09 | 124.36 | 124.36 | 15.03 | 15.03 |
| Cb-C | 1 | 23.06 | 23.06 | -32.19 | -32.19 | 11.18 | 11.18 |
| Cb-N | 1 | -2.09 | -2.09 | 40.56 | 40.56 | 18.42 | 18.42 |
| Cb-H | 4 | 13.81 | 55.24 | 48.26 | 193.04 | 17.16 | 68.64 |
| ∑ | 8 | 54.11 | 453.06 | 126.83 | |||
| орто-поправка | 1 | 1.42 | |||||
| поправка на симм. | σнар=1 | σвнутр=3 | -9.134 | ||||
| ΔHo | 55.53 | So | 443.926 | Сpo | 126.830 |
Рассчитаем для этого соединения энтальпию и энтропию образования методом Татевского по связям по второму уровню приближения.
|
| Кол-во вкладов | Парц. вклад, кДж/моль | Вклад в энтальпию кДж/моль |
| (Cb-H)1 | 4 | 13,877 | 55,508 |
| Cb-NH2 | 1 | 18,42 | 18,42 |
| (Cb-C1)1 | 1 | -19,121 | -19,121 |
| ∑ | 6 | 54,807 | |
|
| ΔHo | 54,807 |
Задание №2
Для первого соединения рассчитать  и
и 
Триметилгептан
Энтальпия.

где  -энтальпия образования вещества при 730К;
-энтальпия образования вещества при 730К;  -энтальпия образования вещества при 298К;
-энтальпия образования вещества при 298К;  -средняя теплоемкость.
-средняя теплоемкость.
 ;
;

Для расчета из таблицы Бенсона выпишем парциальные вклады  соответственно для 298К, 400К, 500К, 600К, 800К и путем интерполяции найдем
соответственно для 298К, 400К, 500К, 600К, 800К и путем интерполяции найдем  для 730К., и
для 730К., и  для элементов составляющих соединение.
для элементов составляющих соединение.
Таблица 5
| Кол-во вкладов | Сpi, 298K, | Сpi, 400K, | Сpi, 500K, | Сpi, 600K, | Сpi, 730K, | Сpi, 800K, | ||||||||||
| СН3-(С) | 5 | 25.910 | 32.820 | 39.950 | 45.170 | 51.235 | 54.5 | |||||||||
| СН-(3С) | 1 | 19.000 | 25.120 | 30.010 | 33.700 | 37.126 | 38.97 | |||||||||
| С-(4С) | 1 | 18.29 | 25.66 | 30.81 | 33.99 | 35.758 | 36.71 | |||||||||
| СН2-(2С) | 3 | 23.02 | 29.09 | 34.53 | 39.14 | 43.820 | 46.34 | |||||||||
| ∑ | 10 | 235.900 | 302.150 | 364.160 | 410.960 | 460.516 | ||||||||||
| С | 10 | 28.836 | 29.179 | 29.259 | 29.321 | 29.511 | 29.614 | |||||||||
| Н2 | 11 | 403.636 | 440.259 | 468.119 | 491.151 | 512.824 |
| |||||||||
| ∑ | 28.836 | 29.179 | 29.259 | 29.321 | 29.511 | 29.614 | ||||||||||
 ,
,



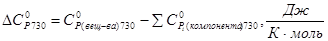





Энтропия.


Для расчета из таблицы Бенсона выпишем парциальные вклады  соответственно для 298К, 400К, 500К, 600К, 800К и путем интерполяции найдем
соответственно для 298К, 400К, 500К, 600К, 800К и путем интерполяции найдем  для 730К.
для 730К.
Таблица 5
| Кол-во вкладов | Сpi, 298K, | Сpi, 400K, | Сpi, 500K, | Сpi, 600K, | Сpi, 730K, | Сpi, 800K, | |
| СН3-(С) | 5 | 25.910 | 32.820 | 39.950 | 45.170 | 51.235 | 54.5 |
| СН-(3С) | 1 | 19.000 | 25.120 | 30.010 | 33.700 | 37.126 | 38.97 |
| С-(4С) | 1 | 18.29 | 25.66 | 30.81 | 33.99 | 35.758 | 36.71 |
| СН2-(2С) | 3 | 23.02 | 29.09 | 34.53 | 39.14 | 43.820 | 46.34 |
| ∑ | 10 | 235.900 | 302.150 | 364.160 | 410.960 | 460.516 |


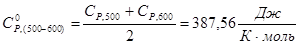


Задание №3
Для четырех соединений, приведенных в таблице, рекомендованными методами вычислить (жидкость-пар) температуру, критическое давление, критический объем, ацентрический фактор.
Метод Лидерсена.
Критическую температуру находим по формуле:

где  -критическая температура;
-критическая температура; 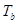 -температура кипения (берем из таблицы данных);
-температура кипения (берем из таблицы данных); 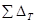 -сумма парциальных вкладов в критическую температуру.
-сумма парциальных вкладов в критическую температуру.
Критическое давление находится по формуле:

где 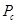 -критическое давление;
-критическое давление;  -молярная масса вещества;
-молярная масса вещества;  -сумма парциальных вкладов в критическое давление.
-сумма парциальных вкладов в критическое давление.
Критический объем находим по формуле:

где  -критический объем;
-критический объем;  -сумма парциальных вкладов в критический объем.
-сумма парциальных вкладов в критический объем.
Ацентрический фактор рассчитывается по формуле:
 ;
;
где  -ацентрический фактор;
-ацентрический фактор; 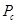 -критическое давление, выраженное в физических атмосферах;
-критическое давление, выраженное в физических атмосферах; 
 -приведенная нормальная температура кипения вещества;
-приведенная нормальная температура кипения вещества;
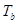 -нормальная температура кипения вещества в градусах Кельвина;
-нормальная температура кипения вещества в градусах Кельвина;
 -критическая температура в градусах Кельвина.
-критическая температура в градусах Кельвина.
Для расчета, выбираем парциальные вклады для каждого вещества из таблицы составляющих для определения критических свойств по методу Лидерсена.
Триметилгептан
Выпишем парциальные вклады для температуры, давления и объема:
| Группа | кол-во | ΔT | ΔP | ΔV |
| СН3-(С) | 5 | 0.1 | 1.135 | 275 |
| СН2-(2С) | 3 | 0.06 | 0.681 | 165 |
| СН-(3С) | 1 | 0.012 | 0.21 | 51 |
| С-(4С) | 1 | 0 | 0.21 | 41 |
| ∑ | 10 | 0.172 | 2.236 | 532 |
Критическая температура.


Критическое давление.

 .
. 
Критический объем.
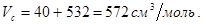
Ацентрический фактор.
Поскольку для вещества отсутствуют экспериментальные значения критических параметров, используем параметры, полученные методом Лидерсена.
 ;
; 



Циклогексан
Выпишем парциальные вклады для температуры, давления и объема:
| Группа | к-во |
|
|
| |||
| (CH2)цикл | 6 | 0.078 | 1.104 | 267 | |||
| Сумма | 6 | 0.078 | 1.104 | 267 |
Критическая температура.


Критическое давление.


Критический объем.

Ацентрический фактор.





Этилнонаноат
Выпишем парциальные вклады для температуры, давления и объема:
| Группа | кол-во | ΔT | ΔP | ΔV |
| CН3 | 2 | 0.04 | 0.454 | 110 |
| CH2 | 8 | 0.16 | 1.816 | 440 |
| -CОО- | 1 | 0.047 | 0.47 | 80 |
| Сумма | 11 | 0.247 | 2.74 | 630 |
Критическая температура.



Критическое давление.
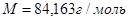 ;
; 
Критический объем.

Ацентрический фактор.


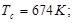


Орто-Толуидин
Выпишем парциальные вклады для температуры, давления и объема:
| Группа | кол-во | ΔT | ΔP | ΔV |
| СН3- | 1 | 0.02 | 0.227 | 55 |
| -CH= (цикл.) | 4 | 0.044 | 0.616 | 148 |
| >C= (цикл.) | 2 | 0.022 | 0.308 | 72 |
| NH2 - | 1 | 0.031 | 0.095 | 28 |
| Сумма | 8 | 0.117 | 1.246 | 303 |
Критическая температура.


Критическое давление.


Критический объем.

Ацентрический фактор.




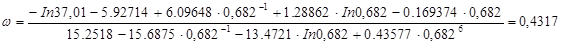 .
.
Метод Джобака.
Критическую температуру находим по уравнению;

где  -критическая температура;
-критическая температура;  -температура кипения (берем из таблицы данных);
-температура кипения (берем из таблицы данных);
 -количество структурных фрагментов в молекуле;
-количество структурных фрагментов в молекуле;  -парциальный вклад в свойство.
-парциальный вклад в свойство.
Критическое давление находим по формуле:

где  -критическое давление в барах;
-критическое давление в барах;  -общее количество атомов в молекуле;
-общее количество атомов в молекуле; 
 -количество структурных фрагментов;
-количество структурных фрагментов;  -парциальный вклад в свойство.
-парциальный вклад в свойство.
Критический объем находим по формуле:

где  -критический объем в
-критический объем в  ;
; 
 -количество структурных фрагментов;
-количество структурных фрагментов;  -парциальный вклад в свойство.
-парциальный вклад в свойство.
Для расчета, выбираем парциальные вклады в различные свойства для каждого вещества из таблицы составляющих для определения критических свойств по методу Джобака.
Триметилгептан
Выпишем парциальные вклады для температуры, давления и объема:
| Группа | кол-во | ΔT | ΔP | ΔV |
| СН3- | 5 | 0.0705 | -0.006 | 325 |
| ,-СН2- | 3 | 0.0567 | 0 | 168 |
| >СН- | 1 | 0.0164 | 0.002 | 41 |
| >С< | 1 | 0.0067 | 0.0043 | 27 |
| ∑ | 10 | 0.1503 | 0.0003 | 561 |
Критическая температура.


Критическое давление.
 ;
; 
Циклогексан
Выпишем парциальные вклады для температуры, давления и объема:
| Группа | к-во | ΔT | ΔP | ΔV |
| (CH2)цикл | 6 | 0.06 | 0.015 | 288 |
| Сумма | 6 | 0.06 | 0.015 | 288 |
Критическая температура.


Критическое давление.
 ;
; 
Этилнонаноат
Выпишем парциальные вклады для температуры, давления и объема:
| Группа | кол-во | ΔT | ΔP |
| CН3 | 2 | 0.0282 | -0.0024 |
| CH2 | 8 | 0.1512 | 0 |
| -CОО- | 1 | 0.0481 | 0.0005 |
| Сумма | 11 | 0.2275 | -0.0019 |
Критическая температура.



Критическое давление.
 ;
; 
Орто-Толуидин
Выпишем парциальные вклады для температуры, давления и объема:
| Группа | кол-во | ΔT | ΔP |
| СН3- | 3 | 0.0423 | -0.0036 |
| (=CH)(ds) | 3 | 0.0246 | 0.0033 |
| (=C)(ds) | 2 | 0.0286 | 0.0016 |
| NH2 | 1 | 0.0243 | 0.0109 |
| Сумма | 9 | 0.1198 | 0.0122 |
Критическая температура.


Критическое давление.
 ;
; 
Задание №4
Для первого соединения рассчитать  ,
,  и
и 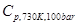 . Определить фазовое состояние компонента.
. Определить фазовое состояние компонента.
Энтальпия
Триметилгептан
Для расчета  ,
,  и
и  воспользуемся таблицами Ли-Кеслера и разложением Питцера.
воспользуемся таблицами Ли-Кеслера и разложением Питцера.

где  - энтальпия образования вещества в стандартном состоянии;
- энтальпия образования вещества в стандартном состоянии;  -энтальпия образования вещества в заданных условиях;
-энтальпия образования вещества в заданных условиях; 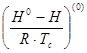 и
и 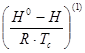 -изотермические изменения энтальпии.
-изотермические изменения энтальпии.
Находим приведенные температуру и давление:


по этим значениям с помощью таблицы Ли-Кеслера и разложения Питцера интерполяцией находим изотермическое изменение энтальпии.


Из правой части выражаем: 
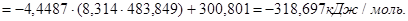
Энтропия

где  энтропия вещества в стандартном состоянии;
энтропия вещества в стандартном состоянии;  - энтропия вещества в заданных условиях;
- энтропия вещества в заданных условиях;  -ацентрический фактор.
-ацентрический фактор.
Критические параметры вещества определяем методом Лидерсена.

 ; R=8,314Дж/моль*К
; R=8,314Дж/моль*К


Находим приведенные температуру и давление:


по этим значениям с помощью таблицы Ли-Кесслера и разложения Питцера интерполяцией находим изотермическое изменение энтропии.


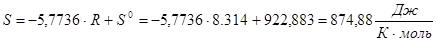
Теплоемкость.

где  - теплоемкость соединения при стандартных условиях;
- теплоемкость соединения при стандартных условиях;  - теплоемкость соединения при заданных условиях;
- теплоемкость соединения при заданных условиях;  -ацентрический фактор.
-ацентрический фактор.
Критические параметры вещества определяем методом Лидерсена.

 ; R=8,314Дж/моль*К
; R=8,314Дж/моль*К


Находим приведенные температуру и давление:

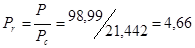
по этим значениям с помощью таблицы Ли-Кесслера и разложения Питцера интерполяцией находим изотермическое изменение теплоемкости.

 Дж/моль*К
Дж/моль*К
Из правой части выражаем:

Задание №5
Для первого соединения рассчитать плотность вещества при температуре 730 К и давлении 100 бар. Определить фазовое состояние компонента.
Для определения плотности вещества воспользуемся методом прогнозирования плотности индивидуальных веществ с использованием коэффициента сжимаемости.

где  -плотность вещества; М- молярная масса; V-объем.
-плотность вещества; М- молярная масса; V-объем.
Для данного вещества найдем коэффициент сжимаемости с использованием таблицы Ли-Кесслера по приведенным температуре и давлении.
Коэффициент сжимаемости находится по разложению Питцера:

где Z-коэффициент сжимаемости;  -ацентрический фактор.
-ацентрический фактор.
Приведенную температуру найдем по формуле 
где  -приведенная температура в К; Т-температура вещества в К;
-приведенная температура в К; Т-температура вещества в К;  -критическая температура в К.
-критическая температура в К.
Приведенное давление найдем по формуле  ; где
; где  - приведенное; Р и
- приведенное; Р и  давление и критическое давление в атм. соответственно.
давление и критическое давление в атм. соответственно.
Критические температуру и давление а так же ацентрический фактор возьмем экспериментальные.
Критические параметры вещества определяем методом Лидерсена.

 ; R=8,314Дж/моль*К
; R=8,314Дж/моль*К


Находим приведенные температуру и давление:


Коэффициент сжимаемости найдем из разложения Питцера:
путем интерполяции находим  и
и  .
.
 =0,8190;
=0,8190;
 =0,2356;
=0,2356;

Из уравнения Менделеева-Клайперона  ,
,
где P-давление; V-объем; Z- коэффициент сжимаемости; R-универсальная газовая постоянная (R=82.04); T-температура;
выразим объем:
 2020-01-14
2020-01-14 138
138









