На рисунке 8 показана схема созданного нами биосенсора на P.aeruginosa АТСС 27853 с наноразмерной по координате электрохимической реакции биохимически активной мембраной.

Рисунок 8. Схема компановки биосенсора с нанопреходами по координате электрохимической реакции для регистрации P. aeruginosa АТСС 27853.
Взаимодействие антиген-антитело приводит к изменению электростатических характеристик ДЭС, следствием чего является рост тока во внешней цепи электрохимической ячейки.
Поскольку большая доля биосенсоров, в состав которых входит трандьюсер, является электрохимическими устройствами, то их работоспособность и воспроизводимость измеряемых данных в значительной мере зависит от материала рабочего электрода, его чистоты. Для массового производства биосенсоров можно использовать Pt о.с.ч. 00 и Au о.с.ч. 00.
Нами проведено изучение электрохимического поведения Pt о.с.ч. 00 и Au о.с.ч. 00 в фосфатном буферном растворе (PBS),который использовался в качестве поддерживающего электролита. На рис. 9 показаны ВАХ (вольтамперные характеристики) от межфазной границы раздела Pt/ PBS в зависимости от скорости развертки (V/s) по потенциалу Е. При медленных развертках ЦВАЗ имеет один катодный максимум тока на катодной волне, а сами токи являются токами заряжения. С увеличением скорости развертки величина регистрируемых токов увеличивается, а токи определяются электрической емкостью ДЭС (двойного электрического слоя) межфазной границы. При больших скоростях развертки по потенциалу на ЦВАЗ не наблюдается токовых максимумов, а анодный и катодный ток плавно увеличивается или уменьшается в зависимости от потенциала. Анодная и катодная зависимости ВАХ обусловлены двумя процессами заряжения. Pt после подготовки активная, на что указывают большие анодные и катодные токи электродных процессов, которые реализовываются на ней. Однако форма и характер этих кривых указывает на то, что она находится в состоянии окисления. На рисунке 9 показаны ЦВАЗ при малых скоростях развертки по потенциалу в увеличенном масштабе по сравнению с рисунком 10. При самой медленной скорости развертки по потенциалу в диапазоне от 0.000 до 0.800 В через межфазную границу текут наноамперные токи, указывая на хорошую поляризуемость Pt электрода и на то, что для анодной волны протекают лишь токи заряжения.

Рисунок 9.ЦВАЗ Pt/ PBS. Рабочий электрод Pt 00. S = 0.53 см2. Электрод сравнения хлорсеребряный. Насыщен. KСl. Крутизна 1 мА/V. 1 – V/s = 5•100; 2 – V/s = 5•10-1; 3 – V/s = 5•10-2; 4 – V/s = 5•10-3.
Параметры потенциостата:
|
| mV | T |
| mV | S (V/s) |
| шаг 1 | 0 | 10 с | шаг 5 | 1100 | 5·10(0) |
| шаг 2 | 0 | 1 с | шаг 6 | 0 | 5·10(0) |
| шаг 3 | 0 | 1 с | шаг 7 | 1100 | 5·10(0) |
| шаг 4 | 0 | 1 с | шаг 8 | -300 | 5·10(0) |

Рисунок 10. ЦВАЗ Pt/ PBS. Рабочий электрод – Pt 00. S = 0.53 см2. Крутизна 1 мА/V. 3 – V/s = 5·10-2; 4 – V/s = 5·10-3.
Параметры потенциостата:
| mV | t | mV | S (V/s) | ||
| шаг 1 | 0 | 10 с | шаг 5 | 1100 | 5·10(-2) |
| шаг 2 | 0 | 1 с | шаг 6 | 0 | 5·10(-2) |
| шаг 3 | 0 | 1 с | шаг 7 | 1100 | 5·10(-2) |
| шаг 4 | 0 | 1 с | шаг 8 | -300 | 5·10(-2) |
ЦВАЗ, полученную на Pt 00 после обработки в растворе концентрированной HNO3 и обработанную дополнительно в растворе пираньи, мы сравнили с ЦВАЗ, полученной на Pt 00 после обработки в растворе царской водки и обработанной в растворе пираньи (рис. 10). Сравнение кривых "1", "2" и "3" показывает, что в последнем случае поверхностный оксид снят с поверхности Pt 00, а ЦВАЗ, полученная в последнем случае, имеет два максимума тока. Первый, при потенциале 0,03 В, второй при потенциале 0,10 В характерных для адсорбции разных форм водорода в растворах кислот как на чистой платине, так и на разных индексных гранях в соответствии с работами Делахея. После нанесения на поверхность Pt 00 наномолекулярного слоя антитела к P. aeruginosa АТСС 27853 активность Pt 00 электрода подавляется рис.11, кривая "3". При катодных потенциалах восходящая ветвь ЦВАЗ на Pt электроде, который содержит 2 наноразмерных слоя антител совпадает с восходящими кривыми "1", "2". При анодных потенциалах эта же кривая 3 совпадает с кривой 4 как на восходящем, так и на нисходящем, участках ЦВАЗ. Таким образом, наноразмерный 2-молекулярный слой антител модифицирует поверхность Pt электрода и ограничивает минимальные токи, которые проходят через эту границу как в анодной области, так и в катодной. К этому факту мы вернемся позже, при обсуждении взаимодействия этой модифицированной межфазной границы с антигенами P. aeruginosa АТСС 27853. Важным является также тот факт, что на катодной волне пиков тока восстановления оксида Pt ни в одном из данных случаев не наблюдается. Это указывает на то, что поверхность Pt электрода ни в одном из них не окисляется. Форма и ход ЦВАЗ в фосфатном буфере зависит лишь от токов заряжения межфазной границы и обусловлена ориентацией молекул воды, ионов гидроксония и ОН – групп на поверхности электрода и количеством этих частей, которые вошли в ДЭС.

Рисунок 11. ЦВАЗ Pt/ PBS. Рабочий электрод Pt 00. S = 0.53 см2. Крутизна 1 мА/V. Скорость развертки V/s = 5·100. 1 – чистая Pt обработанная в растворе конц. HNO3 40 мин. и потом в растворе пираньи; 4 – чистая Pt обработанная в царской водке 10 мин., затем в растворе пираньи; 3 – Pt/ 2 наномолекулярных слоев ІМ АСКМ/ PBS; 2 – чистая Pt обработанная в царской водке, в растворе конц. HNO3 40 мин., затем в растворе пираньи.
Параметры потенциостата:
| mV | t | mV | S (V/s) | ||
| шаг 1 | 0 | 10 с | шаг 5 | 1100 | 5·10(0) |
| шаг 2 | 0 | 1 с | шаг 6 | 0 | 5·10(0) |
| шаг 3 | 0 | 1 с | шаг 7 | 1100 | 5·10(0) |
| шаг 4 | 0 | 1 с | шаг 8 | -300 | 5·10(0) |

Рисунок 12. ЦВАЗ Pt/ PBS. Рабочий электрод – Pt 00. S = 0.53 см2. Крутизна 1 мА/V. Скорость развертки V/s = 5·100. а: 1 – в чистом PBS (pH = 7,4); 2 – с добавкою 0.32 мл раствора антигенов P.aeruginosa АТСС 27853 у PBS, τ = 1 мин.; 3 – 15 мин.
Параметры потенциостата:
| mV | T | mV | S (V/s) | ||
| шаг 1 | 0 | 10 с | шаг 5 | 1100 | 5·10(0) |
| шаг 2 | 0 | 1 с | шаг 6 | 0 | 5·10(0) |
| шаг 3 | 0 | 1 с | шаг 7 | 1100 | 5·10(0) |
| шаг 4 | 0 | 1 с | шаг 8 | -300 | 5·10(0) |
Представляло интерес определить, изменяет ли характеристики ЦВАЗ, полученные на чистой Pt, введение в фосфатный буфер антигенов P. aeruginosa АТСС 27853. На рисунке 12 показаны, как ЦВАЗ, полученная от межфазной границы Pt/ PBS, (рис. 12. линия "1"), так и ЦВАЗ после введения в исходный раствор антигенов P. aeruginosa АТСС 27853 (рис. 12, линии 2, 3). Следует подчеркнуть, что данные, представленные на рис. 12 линией "1" и линиями "2" и "3", получены в независимых экспериментах. Из этого следует, что введение в исходный раствор антигенов приводит к появлению на анодных и катодных ветвях ЦВАЗ соответственно вольтамперометрических максимумов окисления и восстановления антигенов P. aeruginosa АТСС 2785. С увеличением времени контакта с электродом ток в их пиках растет. Адсорбция продуктов превращения P.aeruginosa АТСС 2785 при потенциалах положительней пика окисления и отрицательней пика восстановления растет, на что указывает уменьшение соответствующих токов в сравнении с токами, которые протекают в этих областях потенциалов в системе Pt/ PBS. Адсорбция этих продуктов с ростом времени выдержки платины в растворе растет.
Таким образом, присутствие Red/ox максимумов на ЦВАЗ, а, следовательно, и наличие стандартной ЭДС однозначно указывает на то, что они обусловлены именно введением в чистый раствор фосфатного буфера антигенов P. aeruginosa АТСС 27853. Следствием наличия Red/ox потенциала является то, что антигены P. aeruginosa АТСС 27853 в растворе электролита находятся в двух формах и непрерывно переходят друг в друга. Поэтому мы однозначно можем записать это динамическое равновесие в форме:
Ox P. aeruginosa АТСС 27853 + ē = Red P. aeruginosa АТСС 27853. (6)
Таким образом, выясняется, что антигены P. aeruginosa АТСС 27853 в растворе находятся в двух разно заряженных Red и Ox формах, и именно эти формы переходят друг в друга, соударяясь из Pt индифферентным электродом, который является лишь переносчиком электронов между ними. Данные рисунка 12 позволяют найти стандартную ЭДС этой цепи:
 . (7)
. (7)
Из курса электрохимии известно, что каждая электрохимическая редокс пара имеет свой, строго постоянный потенциал. Следовательно, стандартная ЕДС

это прирожденное свойство редокс форм антигенов P. aeruginosa АТСС 27853. Это важнейший признак, по которому может быть определено в электрохимической системе наличие антигенов P. aeruginosa АТСС 27853. В сущности Pt электрод уже является биосенсором на антиген P. aeruginosa АТСС 27853. Однако чувствительность такого биосенсора к ионам антигенов мала и составляет 1 ÷ 5•10–6 М•л–1. В тоже время такой биосенсор не является избирательным по отношению к антигенам P. aeruginosa АТСС 27853, поскольку на таком электроде в случае наличия в системе посторонних антигенов и других заряженных примесей могут начать протекать большие токи, которые замаскируют редокс пики от антигенов P. aeruginosa АТСС 27853.
Создаваемый нами реальный эффективный биосенсор должен быть избирательный именно к антигенам P. aeruginosa АТСС 27853. С этой целью необходимо так модифицировать рабочую поверхность биосенсора, чтобы она была избирательна лишь к анализируемому антигену и давала бы аналитический сигнал по крайней мере в 10 раз превышающий сигнал, полученный от чистого электрода Pt. Ниже мы опишем роботу модифицированных Pt и Au подкладок, которые нам удалось получить, и которые являются избирательными и более чувствительными по отношению к антигенам P. aeruginosa АТСС 27853.
Кроме Рt-подкладки для создания биосенсора нам предсталяется возможным использовать Au индифферентный электрод. В работе мы использовали два Au электрода: плоский электрод с большой поверхностью (S = 1.04 см2) и малый цилиндрический с площадью равной 0.306 см2.
На рисунке 13 показаны экспериментальные ЦВАЗ, полученные в фоновом электролите на малом цилиндрическом Au 00 электроде в зависимости от скорости развертки потенциала. Они указывают на то, что прохождение тока через межфазную границу Au/ PBS сложнее, чем для межфазной границы Pt/ PBS рассмотренной выше.

Рисунок 13. ЦВАЗ Au/ PBS. Рабочий электрод – Au 00. S = 0.306 см2. Крутизна 1 мА/V. Скорость развертки: 1 – V/s = 5·100; 2 – V/s = 5·10-1; 3 – V/s = 5·10-2.
Параметры потенциостата:
| mV | T | mV | S (V/s) | ||
| шаг 1 | 0 | 10 с | шаг 5 | 1100 | 5·10(0) |
| шаг 2 | 0 | 1 с | шаг 6 | 0 | 5·10(0) |
| шаг 3 | 0 | 1 с | шаг 7 | 1100 | 5·10(0) |
| шаг 4 | 0 | 1 с | шаг 8 | -300 | 5·10(0) |
Аналогичная картина наблюдается и для Аu-электрода с большой поверхностью, данные для которой показаны на рисунках 14 – 15 при разных скоростях развертки по потенциалу.

Рисунок 14. ЦВАЗ Au/ PBS. Рабочий электрод – Au 00. S = 1.04 см2. Электрод сравнения хлорсеребряный. Насыщенный KCl. Крутизна 1 мА/V. Скорость развертки: 1 – V/s = 5·100; 2 – V/s = 5·10-1; 3 – V/s = 5·10-2.
Параметры потенциостата:
| mV | T | mV | S (V/s) | ||
| шаг 1 | 0 | 10 с | шаг 5 | 1100 | 5·10(0) |
| шаг 2 | 0 | 1 с | шаг 6 | 0 | 5·10(0) |
| шаг 3 | 0 | 1 с | шаг 7 | 1100 | 5·10(0) |
| шаг 4 | 0 | 1 с | шаг 8 | -300 | 5·10(0) |
При малых скоростях развертки по потенциалу межфазная граница Au/ PBS приближается по своим электрохимическим свойствам к межфазного границе Pt/ PBS, хотя пик тока при потенциале 0,24 В (х.с.е.) присутствует на ЦВАЗ, но величины тока слабо зависят от потенциала при минимальной скорости развертки по потенциалу.
Для того чтобы понять, насколько чисто выполняется наш биоэлектрохимический эксперимент достаточно сравнить измерения ЦВАЗ выполненные на большом и малом

Рисунок 15. ЦВАЗ Au/ PBS. Рабочий электрод – Au 00. Крутизна 1 мА/V. 1 – Sб = 1.04 см2; 2 – Sм= 0,306 см2. Скорость развертки V/s = 5·100.
Параметры потенциостата:
| mV | T | mV | S (V/s) | ||
| шаг 1 | 0 | 10 с | шаг 5 | 1100 | 5·10(0) |
| шаг 2 | 0 | 1 с | шаг 6 | 0 | 5·10(0) |
| шаг 3 | 0 | 1 с | шаг 7 | 1100 | 5·10(0) |
| шаг 4 | 0 | 1 с | шаг 8 | -300 | 5·10(0) |
На рисунке 15 представлено такое сравнение при одинаковых экспериментальных условиях и при одинаковой скорости развертки по потенциалу при пересчете ЦВАЗ на единичную площадь Аu-электродов. Полученные кривые практически совпадают. На большом пластинчатом электроде Au более выразительно выражен токовый максимум.
Некоторые отличия в величинах токов наблюдаем при анодных потенциалах. Такие небольшие отличия можно объяснить разной гидродинамикой и разным вкладом краевых эффектов на величину распределения тока на электродах с разной конфигурацией. Необходимо также учесть то, что пластинчатый электрод не равнодоступен для тока, который протекает через его разные участки. В целом же наблюдается практически полное совпадение этих ЦВАЗ. Таким образом, в наших экспериментах достигнута очень высокая чистота, воспроизводимость и точность экспериментальных данных.
Эта зависимость токов указывает на то, что нанесение на Pt и Au электроды 2 наномолекулярных слоев антител вполне достаточно для того, чтобы межфазная граница стойко функционировала как датчик биосенсорного устройства. При этом мера заполнения поверхности Pt и Au электродов двумя мономолекулярными слоями равняется 1, то есть вся поверхность модифицированных Pt и Au электродов закрыта антителами и внешней электродной поверхностью уже являются концы молекул антител к P. aeruginosa АТСС 27853. Создание на поверхности Au электрода мономолекулярных и полимолекулярных поверхностных слоев позволяет впритык подойти к получению биосенсоров. В соответствии с выбранной стратегией мы нанесли на поверхность пластинчатого электрода Pt с помощью специальных методов 2 наномолекулярных слоев антител АСКМ и иммобилизировали их к поверхности подкладки. ЦВАЗ снимали в фосфатном буферном растворе. На рисунке 16, линия "2" показывает отзыв межфазной границы Pt/ 2НАНО ИМ АСКМ / PBS на зондирование ее треугольными импульсами напряжения. Для сравнения на этом же рисунке (линия "2") приведена ЦВАЗ, полученная на чистом Pt электроде.

Рисунок 16. ЦВАЗ Pt/ 2НАНО ІМ АСКМ/ PBS. Рабочий электрод - Pt 00. S = 0.53 см2. Крутизна 1 мА/V. Скорость развертки V/s = 5·100. 1 – чистая Pt (х = 0); 2 – Pt с х = 4НАНО ІМ АСКМ.
Параметры потенциостата:
| mV | T | mV | S (V/s) | ||
| шаг 1 | 0 | 10 с | шаг 5 | 1100 | 5·10(0) |
| шаг 2 | 0 | 1 с | шаг 6 | 0 | 5·10(0) |
| шаг 3 | 0 | 1 с | шаг 7 | 1100 | 5·10(0) |
| шаг 4 | 0 | 1 с | шаг 8 | -300 | 5·10(0) |
Из сопоставления этих данных выходит, что 2 мономолекулярных слоя нанесенных на Рt-подкладку приводят к понижению токов что протекают через межфазную границу Pt/ 2НАНО ИМ АСКМ/ PBS. При этом вся ЦВАЗ от межфазной границы Pt/ 2НАНО ИМ АСКМ/ PBS расположена внутри ЦВАЗ от межфазной границы Pt/ PBS. Такое уменьшение токов в случае ЦВАЗ(2) обусловлено наличием на поверхности Pt подкладки хорошо связанных с ней антител АСМК, которые образуют физический барьер с определенным сопротивлением. Таким образом, падение прилагаемого напряжения происходит уже не только в области ДЭС, но и в наномолекулярной пленке. Именно оно определяет падение тока на межфазной границе Pt/ 2НАНО ИМ АСКМ/ PBS по сравнению с Pt/ PBS. Наиболее большие отклонения от исходной ЦВАЗ наблюдаются при катодных потенциалах как на ниспадающей, так и на растущей, ветвях ЦВАЗ. При анодных потенциалах эти ветви ЦВАЗ практически совпадают.

Рисунок 17. ЦВАЗ Pt/ 2НАНО ІМ АСКМ/ PBS. Рабочий электрод - Pt 00. S = 0.53 см2. Крутизна 1 мА/V. Скорость развертки V/s = 5·100. 1 – без P. aeruginosa АТСС 27853; 2 – с P. aeruginosa АТСС 27853, τ = 5 мин
Параметры потенциостата:
| mV | t | mV | S (V/s) | ||
| шаг 1 | 0 | 10 с | шаг 5 | 1100 | 5·10(0) |
| шаг 2 | 0 | 1 с | шаг 6 | 0 | 5·10(0) |
| шаг 3 | 0 | 1 с | шаг 7 | 1100 | 5·10(0) |
| шаг 4 | 0 | 1 с | шаг 8 | -300 | 5·10(0) |
На рисунке 17 представлена ЦВАЗ (линия "2"), полученная от межфазной границы Pt/ 2НАНО ИМ АСКМ/ PBS через 5 мин. после введения в раствор фосфатного буфера антигенов P. aeruginosa АТСС 27853. Введение антигенов в систему приводит к росту токов при катодных потенциалах нисходящей и восходящей ветвей ЦВАЗ. Однако ожидаемых вольтамперометрических максимумов на ней не наблюдается. Поэтому рабочий электрод мы выдержали в PBS на протяжении 18 час. После этого опять произвели регистрацию ЦВАЗ.
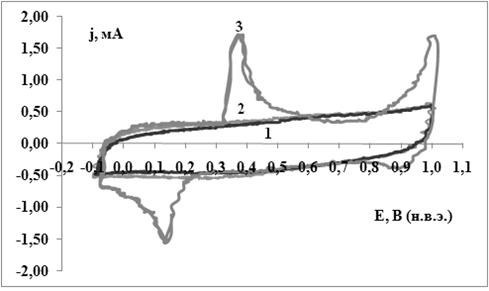
Рисунок 18. ЦВАЗ Pt/ 2НАНО ІМ АСКМ/ PBS. Рабочий электрод - Pt 00. S = 0.53 см2. Насыщенный KCl. Крутизна 1 мА/V. Скорость развертки V/s = 5·100.1 – без антигенов P. aeruginosa АТСС 27853; 2 – с P. aeruginosa АТСС 27853, τ = 5 мин.; 3 – с P. aeruginosa АТСС 27853, τ = 18 часов.
Параметры потенциостата:
| mV | t | mV | S (V/s) | ||
| шаг 1 | 0 | 10 с | шаг 5 | 1100 | 5·10(0) |
| шаг 2 | 0 | 1 с | шаг 6 | 0 | 5·10(0) |
| шаг 3 | 0 | 1 с | шаг 7 | 1100 | 5·10(0) |
| шаг 4 | 0 | 1 с | шаг 8 | -300 | 5·10(0) |
Эти данные представлены на рисунке 18 линией "3". Как видно из рисунка, при 0.380 В на анодной ветви ЦВАЗ появился вольтамперометрический максимум тока, а в катодном цикле этой же кривой образуется вольтамперометрический максимум тока восстановления антигенов P. aeruginosa АТСС 27853 при 0.130 В. Найденная из этих данных стандартная ЕДС равна 0.250 В. При сравнении ее с полученной раньше ЕДС для этой же Red/ox системы на чистом электроде Pt и пренебрегая Нернстовским концентрационным членом, получаем их практически полное совпадение. В то же время, токи анодного и катодного максимумов более чем в шесть раз превышают аналогичные токи для вольтамперометрических максимумов, полученных на чистой Pt. Для того, чтобы убедиться, что ток от биосенсора не меняется во времени мы продолжили измерения ЦВАЗ в этой системе. Все параметры измеренных вольтамперных зависимостей стойко повторяются в последующих циклах сканирования.

Рисунок 19. Pt/ 2НАНО ІМ АСКМ/ PBS.
Рабочий электрод - Pt 00. S = 0.53 см2. Электрод сравнения хлорсеребряный. Насыщенный KCl. Крутизна 1 мА/V. Скорость развертки V/s = 5·100. 1 – Pt/ PBS; 2 – Pt/ 2НАНО ІМ АСКМ/ PBS; 3 – + антигены P. aeruginosa АТСС 27853, τ = 5 мин.; 4 – τ = 18 ч.; 5 – τ = 23ч.;6 – τ = 24ч.; 7 – τ = 25 ч. 45 мин.
Параметры потенциостата:
| mV | t | mV | S (V/s) | ||
| шаг 1 | 0 | 10 с | шаг 5 | 1100 | 5·10(0) |
| шаг 2 | 0 | 1 с | шаг 6 | 0 | 5·10(0) |
| шаг 3 | 0 | 1 с | шаг 7 | 1100 | 5·10(0) |
| шаг 4 | 0 | 1 с | шаг 8 | -300 | 5·10(0) |
На рисунке 19 показаны ЦВАЗ, полученные при больших временах выдержки Pt/ 2НАНО ИМ АСКМ в PBS, который содержит P. aeruginosa АТСС 27853. Для токов ЦВАЗ, показанных на этом рисунках, в анодной и в катодной областях потенциалов экспериментальные кривые как перед вольтамперометрическими пиками, так и за ними спадают и приближаются к току, полученному на этом же биосенсоре при отсутствии антигенов P. aeruginosa АТСС 27853. Этот факт является следствием того, что поверхность Pt подкладки модифицирована наномолекулярными слоями антител АСМК, а они избирательно отзываются лишь на взаимодействие комплементарных антиген – антитело. Таким образом, свойства биосесора определяют не Pt электрод и его структура электронных уровней, а наномолекулярный слой антител АСМК и их электронные уровни. Оказалось, что величина тока анодных и катодных пиков непрерывно растет с ростом времени нахождения биосенсора в фосфатном буферном растворе что содержит P. aeruginosa АТСС 27853: Pt / 2НАНО ІМ АСМК/ PBS, P. aeruginosa АТСС 27853 (8)
В электрохимических системах такой рост тока во времени наблюдается лишь для автокаталитических процессов. Такая же зависимость скорости реакции от концентрации субстрата характерна для ферментативных реакций и подчиняется кинетике Михаелиса–Ментен [7].
Оказывается, что и взаимодействие комплементарного наноразмерного слоя антител АСМК, определенным образом ориентированных в ДЕС, с ионами антигенов синегнойной палочки может быть описано аналогичного вида зависимостями (см. раздел 1.1.).
ВЫВОДЫ
1. Установлено, что при определенных условиях биологически активные антитела или антигены принимают участие в процессе электрохимической самосборки наномембраны на инертных подкладках без участия α, ω-тиольного компоновщика.
2. В работе продемонстрирована возможность использования двухмерных наномембран на основе фрагментов F(AB`)2 FITC.как части устройства биосенсора для регистрации иммунного отклика антигенов АСКМ.
3. На Pt и Au электродах получены наномолекулярные пленки антител и антигенов. Проведенные исследования и анализ ЦВАЗ в системе Pt/ 2 наномолекулярных иммобилизованих слоев антител (сыворотки крови мышей, вакцинированных белковым полисахаридом фракцией синегнийной палочки, – АСКМ) в PBS з pH = 7,4, + х М P. aeruginosa АТСС 27853 (Pt/ антитело/антиген).
4. Обнаружены катодные и анодные пики токов специфического взаимодействия антитела с антигенами P. aeruginosa АТСС 27853.
5. Обнаружены катодные и анодные пики токов взаимодействия антигена P. aeruginosa АТСС 27853 в системе "чистая Pt/ PBS".
6. Сконструировано нанобиосенсор относительно комплементарного антигена P. aeruginosa АТСС 27853 и разработан электрохимический метод лабораторной индикации P. aeruginosa АТСС 27853.
СПИСОК ЛИТЕРАТУРЫ
1. Чмиленко Ф.О., Худякова С.М. Осмій–селективні електроди на основі метилтіопірондимеркаптидів. //Науковий вісник Черновецького університету. V Украинский съезд по электрохимии. Химия. 2008. – Випуск 401. – С. 199 – 201.
2. Ковальчук Є.П., Яцишин М.М., Ковалишин Я.С. Речовина в інтерфазі. Фізична хімія тонких плівок. ЛНУ. Львів. 2005. 225 с.
3. Хансен А.Г., Вакербарт Х., Нильсен Дж.У., Жан Ж., Кузнецов А.М., Ульструп Е. Межфазный электронный перенос в наномасштабе и с участием отдельной молекулы. // Электрохимия. 2003. – Т. 39. – В. 1. – С. 117 – 128.
4. Хейнеман, У.Р. Разработка новых тонкослойных спектроэлектрохимических сенсоров, избирательность которых реализуется тремя способами, и их применение [Текст]/ У.Р. Хейнеман, К.Дж. Селискар, Дж.Т. Ричардсон //Электрохимия. - 2003. – Т. 39. – В. 8. – С. 982 – 993.
5. Шеллер, Ф. Ферменты в электрохимических биосенсорах [Текст] / Ф. Шеллер, Д. Кирштайн, Ф. Шуберт, Д. Пфайффер, К. МкНейл //Электрохимия. - 1993. – Т. 29. – В. 12. – С. 1522 – 1527.
6. Сикейра, Ц.А.К. Перспективы сенсоров для оценки биологически индуцируемой агрессивности среды [Текст]/ Ц.А.К. Сикейра //Электрохимия. - 1993. – Т. 29. – В. 12. – С. 1541 – 1553.
7. Шульга, А.А. Тонкоплёночные кондуктометрические энзимобиосенсоры для определения глюкозы и мочевины в крови [Текст]/ А.А. Шульга, С.В. Дзядевич, А.П. Солдаткин, С.В. Пацковский, Н.Ф. Стародуб, В.И. Стриха, А.В. Ельская //Электрохимия. - 1993. – Т. 29. – В. 8. – С. 998 – 1002.
8. Хитченс, Г.Д. Измерение бактериальной активности методом медиаторной амперометрии в проточно-инжекционной системе [Текст]/ Г.Д Хитченс, Д. Ходко, Д.Р. Миллер, О.Дж. Мурфи, Т.Д. Роджерс //Электрохимия. - 1993. – Т. 29. – В. 12. – С. 1534 – 1540.
9. Тарасевич, М.Р. Электрохимические биосенсоры [Текст]/ М.Р. Тарасевич, В.А. Богдановская, Г.В. Жутаева //Электрохимия. - 1993. – Т. 29. – В. 12. – С. 1554 – 1560.
10. Чвірук, В. Досягнення та перспективи розвитку у галузі електрохіммічних сенсорів для моніторингу повітряного середовища [Текст] / В. Чвірук /Труды III съезда по электрохимии. Вістник Львівського університету.- 2002. – В. 42. – Ч. 1. – С. 178 –181.
11. Чмиленко, Ф. Хімичні сенсори як засоби екологічного контролю вмісту поліелектролітів у водних розчинах [Текст] / Ф. Чмиленко, І. Коробова, О. Мікуленко /Труды III съезда по электрохимии. Вістник Львівського університету. - 2002. – В. 42. – Ч. 1. – С. 178 –181.
12. Ковальчук, Є.П. Полімерні платформи для ензимних електродів [Текст] / Є.П. Ковальчук, Б.Б.Остапович, З.Л.Турик, Є. Блажейовський /Труды IV съезда по электрохимии. Вістник ХНУ. 2005. – № 648. – С. 68 – 71.
13. Курись, Я. Матрична електрополімеризація – метод одержання поліанілину та поліпіролу, які чутливі до амінокислот [Текст] / Я.Курись, Н.Нетяга, В.Походенко /Труды III съезда по электрохимии. Вістник Львівського університету. -2002. – В. 42. – Ч. 1. – С. 138 – 141.
14. Масконе, Д. Иглообразные глюкозные биосенсоры для мониторинга IN VIVO [Текст] / Д.Масконе, Х.Яманака, М.Масчини //Электрохимия. -1993. – Т.29. – № 12. – С. 1528 – 1533.
15. Александров, Ю. Імпедана синтетичних металів на основі солей TCNQ [Текст] / Ю. Александров, О.Поспєлов, О.Шепеленко, А. Кравченко, Г. Камарчук //Труды III съезда по электрохимии. Вістник Львівського університету.- 2002. – В. 42. – Ч. 1. – С. 124 – 126.
16. Ge B., Huang Y.–C., Sen D., Yu H.Z. Electrochemical investigation of DNA-modified surfaces: From quantitation methods to experimental conditions. // J. Electroanal. Chem. 2007.– V. 602. – P. 156 – 162.
17. Джелали, В.В. БИОСЕНСОРЫ. /В.В. Джелали, А.Ю. Волянский. // Анналы Мечниковского института. 2006. – № 3. – С. 16 – 34.
18. Джелали, В.В. Механизм аномального растворения сталей. / В.В. Джелали, С.В. Нестеренко. // Украинский химический журнал. 2007. – Т. 73. – № 6. – С. 114 – 118.
19. Jelali, V.V. Semiconducting properties of DNA nanomolecular layer. /V.V. Jelali, A. Yu. Volyanskiy. // International Scientific Conferece. "Physical and Chemical Principles of Formation and Modification of Micro- and Nanostructures"FMMN’2007. P. С. 26 – 28.
20. Jelali, V.V. Formation mechanism of semiconductor nanostructures. /V.V. Jelali, S.V. Nesterenko. // International Scientific Conferece. "Physical and Chemical Principles of Formation and Modification of Micro- and Nanostructures"FMMN’2007. P. 35 – 37.
21. Джелали, В.В. Полупроводниковые свойства наномолекулярного слоя ДНК. /В.В. Джелали, А.Ю. Волянский. // Физическая инженерия поверхности. Том 5, № 3 – 4, С. 172 – 185. 2007.
22. Джелали, В.В. Образование полупроводниковой наноструктуры на поверхности аустенитной стали. /В.В. Джелали, С.В. Нестеренко. // Физическая инженерия поверхности. Том 5, № 3 – 4, С. 228 – 237. 2007.
23. Джелали, В.В. Фундаментальний зв'язок між діелектричною проникністю і перенапруженням в електрохімічних системах. /В.В. Джелали, А.Ю. Волянский. // Науковий вісник Черновецького університету. Химия. 2008. – Випуск 401, С. 44 – 46.
24. Джелали, В.В. Зміна коефіцієнтів перенесення заряду в ході електрохімічних реакцій. /В.В. Джелали. // Науковий вісник Черновецького університету. Химия. 2008. – Випуск 399 – 400, С. 59 – 61.
25. Джелали, В.В. Нелінійні опори перенесення заряду електрохімічних реакцій. /В.В. Джелали. // Науковий вісник Черновецького університету. Химия. 2008. – Випуск 401, С. 41 – 43.
26. Джелали, В.В. Исследование взаимодействия "антиген - антитело" на межфазной границе наномембрана из фрагментов овечьих антител к Ig G мышей/ 0,3 M KСl + 0,05 M Na2НРО4 + y μл антигена сыворотки крови мышей. /В.В. Джелали, А.Ю. Волянский, Л.И. Глазунова, А.В. Мартынов, Т.П. Осолодченко, Л.В. Клемчук. // Анналы Мечниковского института. 2009. – № 1. – С. 28 – 34.
 2020-01-14
2020-01-14 363
363







