1. Молярность с — число молей растворенного вещества, содержащихся в 1 дм3 раствора.
2. Моляльность m — число молей растворенного вещества (г), приходящихся на 1000 г растворителя.
3. Мольная доля N — отношение числа молей одного компонента к сумме чисел молей всех компонентов в растворе.
4. Массовая доля вещества ω (весовые проценты) — число граммов одного компонента, содержащихся в 100 граммах раствора.
В бесконечно разбавленных (идеальных) растворах, в которых количество растворенного вещества составляет лишь малую долю количества растворителя, основным компонентом является растворитель.
В бесконечно разбавленном растворе силы взаимодействия между молекулами растворителя в растворене отличаются от сил взаимодействия между молекулами в чистом растворителе.Другими словами добавление второго компонента не влияет на силы межмолекулярного взаимодействия растворителя и изменение свойств раствора зависит только от количества растворенных молекул, но не от их природы. Такие свойства растворов называются коллигативными.
Давление насыщенного пара. Насыщенным называется пар, находящийся в равновесии с жидкостью или твердым телом. Давление насыщенного пара зависит от силы взаимодействия между молекулами вещества (прочности связи между ними).
Изменение давления насыщенного пара с изменением температуры описывается уравнением Клапейрона—Клаузиуса: 
здесь: P — давление насыщенного пара, T — температура, 

∆H — теплота фазового перехода (испарения, возгонки, плавления),
∆V — разность молярных объемов вещества в разных фазах.
При добавлении второго компонента к чистому растворителю, количество молекул растворителя на поверхности уменьшается, что ведет к уменьшению числа испаряющихся молекул растворителя и к понижению давления его насыщенного пара.
Закон Рауля: относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества, т. е. 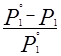 =
= 
Растворы замерзают, как правило, при более низкой температуре, чем чистый растворитель, а кипят при более высокой температуре.
Для бесконечно разбавленных (идеальных) растворов связь между изменениями температуры и концентрацией описывается уравнениями:
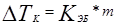

Здесь: ∆TК и ∆TЗ — разность между температурами кипения и замерзания раствора и растворителя соответственно;
т — концентрация растворенного вещества, выраженная в молях на 1000 г растворителя;
KЭБ и KКР — эбулиоскопическая и криоскопическая постоянные растворителя, численно равные изменению температуры кипения и замерзания при т = 1.
Метод определения концентрации и молекулярного веса с помощью измерения температуры кипения называется эбулиоскопией, а с помощью измерения температур замерзания — криоскопией.
Этими же методами можно определять степень диссоциации растворенного вещества в растворе а, для чего в уравнение закона Рауля следует ввести поправку.
Введя поправочный коэффициент i, называемый изотоническим коэффициентом Вант-Гоффа, закон Рауля и его следствия для электролитов записываются следующими формулами
 ;
;  ;
;  .
.
Коэффициент i показывает во сколько раз число частиц в растворе электролита больше, чем молекул при отсутствии диссоциации

Коэффициент Вант-Гоффа i — связан со степенью диссоциации α следующим выражением
 =1+ (ν -1)
=1+ (ν -1)
где ν — число ионов, на которое распадается молекула электролита.
Литература: [1, с. 242-253, 275-288, 225-240, 289-392].
Вопросы для самопроверки:
1. Выведите закон действующих масс.
2. Напишите выражение константы равновесия для реакции
N2+3Н2 = 2NН3
3. Сформулируйте правило смещения химического равновесия.
4. Что такое химическое сродство? Укажите на связь между максимальной работой и константой равновесия.
5. Дайте формулировку закона Рауля и напишите его математическое выражение.
6. Разберите график понижения температуры замерзания разбавленных растворов.
7. Сформулируйте закон Вант-Гоффа и его применимость к растворам различных концентраций и к растворам электролитов.
8. Почему упругость пара над раствором меньше упругости пара над чистым растворителем?
9. В чем сущность гидратной теории растворов Д. И. Менделеева?
10. Укажите значение работ Н. С. Курнакова в создании физико-химического метода анализа. Его практическое применение в товароведении промышленных и продовольственных товаров.
 2020-01-14
2020-01-14 195
195








