Пригожин Илья Романович (25 января 1917, Москва — 28 мая 2003, Брюссель), бельгийский физик и физико-химик русского происхождения, лауреат Нобелевской премии по химии 1977 «за работы по термодинамике необратимых процессов, особенно за теорию диссипативных структур». В Бельгию был привезен родителями из России в раннем детстве.
Яркий представитель брюссельской школы термодинамики необратимых процессов, основанной Теофилом де Донде, Пригожин со студенческих лет принял активное участие в создании термодинамики необратимых процессов. В 1947 он ввел понятие производства энтропии и по-новому сформулировал второе начало термодинамики, распространив его на так называемые открытые системы, обменивающиеся с внешней средой веществом и энергией. В 1947 показал, что в стационарном состоянии при фиксированных внешних параметрах скорость производства энтропии в термодинамической системе минимальна и что для необратимых процессов скорость производства энтропии в открытой системе стремится к минимуму. В 1959-69 г вывел соотношения взаимности Л. Онсагера из кинетических уравнений и термодинамические соотношения для неравновесного газа.
Основная масса его работ посвящена неравновесной термодинамике и статистической механике необратимых процессов. Одно из главных достижений заключалось в том, что было показано существование неравновесных термодинамических систем, которые при определённых условиях, поглощая массу и энергию из окружающего пространства, могут совершать качественный скачок к усложнению (Диссипативные структуры). Причём такой скачок не может быть предсказан, исходя из классических законов статистики. Такие системы позже были названы его именем. Расчёт таких систем стал возможен благодаря его работам, выполненным в 1947 году.
Доказал одну из основных теорем термодинамики неравновесных процессов о минимуме производства энтропии в открытой системе.
Пригожина теорема, доказанная И.Р. Пригожиным (1947) теорема термодинамики неравновесных процессов: при внешних условиях, препятствующих достижению системой равновесного состояния, стационарное состояние системы соответствует минимальному производству энтропии.
Принципы термодинамики были сформулированы в середине XIX в., после изобретения паровой машины, когда взаимодействие тепловой, электрической и механической работы привлекло к себе значительный интерес. Согласно одной из версий первого начала термодинамики, представляющего собой принцип сохранения энергии, в любой закрытой системе энергия не исчезает и не возникает, а переходит из одной формы в другую. Второе начало термодинамики (принцип энтропии) описывает тенденцию систем переходить из состояния большего к состоянию меньшего порядка. Энтропия - это мера беспорядочности, или разупорядоченности, системы. Чем больше разупорядоченность, тем выше энтропия. В XIX в. американский математик и физик Джозайя Уиллард Гиббс разработал теорию статистической термодинамики для обратимых систем в условии равновесия. Теофил де Дондер, профессор Пригожин в Свободном университете и основатель Брюссельской школы термодинамики, сформулировал теорию неравновесных необратимых систем.
Пригожина больше всего интересовали в термодинамике неравновесные специфически открытые системы, в которых либо материя, либо энергия, либо и то и другое обмениваются с внешней средой в реакциях. При этом количество материи и энергии либо количество материи или количество энергии со временем увеличивается или уменьшается. Чтобы объяснить поведение систем, далеких от равновесия, Пригожин сформулировал теорию диссипативных структур. Считая, что неравновесность может служить источником организации и порядка, он представил диссипативные структуры в терминах математической модели с зависимыми от времени нелинейными функциями, которые описывают способность систем обмениваться материей и энергией с внешней средой и спонтанно себя рестабилизировать. Ставший теперь классическим пример диссипативной структуры в физической химии известен как нестабильность Бенарда. Такая структура возникает, когда слои легкоподвижной жидкой среды подогреваются снизу. При достаточно высоких температурных градиентах тепло передается через эту среду, как обычно, и большое число молекул в жидкости образуют специфические геометрические формы, напоминающие живые клетки. [8]
Заключение
Неоспорима роль энергии в поддержании и дальнейшем развитии цивилизации. В современном обществе трудно найти хотя бы одну область человеческой деятельности, которая не требовала бы - прямо или косвенно - больше энергии, чем ее могут дать мускулы человека. В соответствии с различными формами движения материи рассматривают различные формы энергии: механическую, электромагнитную, ядерную и др. Это подразделение до известной степени условно. Так, химическая энергия складывается из кинетической энергии движения электронов и электрической энергии взаимодействия электронов друг с другом и с атомными ядрами.
Энтропия как физическая переменная первично возникла из задач описания тепловых процессов. Впоследствии она стала широко использоваться во всех областях науки. Понятие энтропия, как показал впервые энтропию Шрёдингер (1944), существенно и для понимания явлений жизни. Живой организм с точки зрения протекающих в нём физико-химических процессов можно рассматривать как сложную открытую систему, находящуюся в неравновесном, но стационарном состоянии. Для организмов характерна сбалансированность процессов, ведущих к росту энтропии, и процессов обмена, уменьшающих её. Однако жизнь не сводится к простой совокупности физико-химических процессов, ей свойственны сложные процессы саморегулирования. Поэтому с помощью понятия энтропии нельзя охарактеризовать жизнедеятельность организмов в целом.
В современном мире все большее значение в управлении организацией отдается прогнозированию. Любая организация в процессе своей деятельности сталкивается с различными рисками, которые в большей или меньшей степени влияют на ее состояние. Многочисленны примеры ситуаций, связанных с социальными, технологическими, экономическими, политическими, экологическими и другими рисками. Именно в таких ситуациях обычно и необходимо прогнозирование. Известны различные виды критериев, используемых в теории принятия решений в условиях неопределенности (риска). Из-за противоречивости решений, получаемых по различным критериям, очевидна необходимость применения энтропии.
Яркий представитель брюссельской школы термодинамики необратимых процессов, основанной Теофилом де Донде, Пригожин со студенческих лет принял активное участие в создании термодинамики необратимых процессов. Одно из главных достижений заключалось в том, что было показано существование неравновесных термодинамических систем, которые при определённых условиях, поглощая массу и энергию из окружающего пространства, могут совершать качественный скачок к усложнению (Диссипативные структуры).
Список литературы
1. Аугуста Голдин. Океаны энергии. - Пер. с англ. - М.: Знание, 1998. - 144 с.
2. Баланчевадзе В. И., Барановский А. И. и др.; Под ред. А. Ф. Дьякова. Энергетика сегодня и завтра. - М.: Энергоатомиздат, 1999. - 344 с.
3. Юдасин Л. С.. Энергетика: проблемы и надежды. - М.: Просвещение, 2000. - 207с.
4. Шамбадаль П. Развитие и приложения понятия энтропии. М.: Наука, 2007.
5. Поплавский Р.П. Депон Максвелла и соотношения между информацией и энтропией // УФН. 1999. Т. 128. Вып. 1
6. Кириллин В. А. Энергетика. Главные проблемы: В вопросах и ответах. - М.: Знание, 1990. - 128 с.
7. Энергетические ресурсы мира/ Под ред. П.С.Непорожнего, В.И. Попкова. - М.: Энергоатомиздат, 1995. - 232 с.
8. http://mirslovarei.com/content_fil/PRIGOZHIN-ILJA-ROMANOVICH-R-1917-15828.html
Приложение
Задача №1
Уклон участка дороги равен 1 м на 20 м пути. Спускаясь под уклон при выключенном двигателе, автомобиль движется равномерно со скорость 60 км/ч. Определите мощность двигателя автомобиля, поднимающего по этому уклону с той же скоростью. Масса автомобиля 1,5 т.
Дано:
h=1 м
S=20 м
V=60 км/ч=16,667м/с
m=1500 кг
Найти:
Р -?
Решение:
Мощность определяем по формуле:

Так как скорость постоянная, то ускорение автомобиля равно 0. Тогда сила, действующая на автомобиль, будет равна:

Получаем:


Ответ: Р =12262,5 Вт
Задача №2
Вычислить давление 1 моль молекул газа, занимающего при температуре 300єК объем 1 л.
Дано:
Т=300 єК
V=1 л=0,001 м3
υ=1 моль
Найти:
Р -?
Решение:
Используем формулу Клапейрона-Менделеева:

где - R=8,314 Дж/(моль*єК) – универсальная газовая постоянная.

Ответ: Р = 2,48 МПа.
Задача №3
Средняя кинетическая энергия поступательного движения молекул газа при температуре 5000єК равна 1,6∙10-23Дж. Какова эта энергия при температуре -273єС и 1000єС?
Дано:
Т1=5000єК
Е1=1,6∙10-23Дж
t2=-273єС
t3=1000єС
Найти:
Е2, Е3 -?
Решение:
Средняя кинетическая энергия поступательного движения N молекул газа определяется по формуле:

Так как для данного числа молекул газа N их энергия зависит только от температуры, то:

Получим:

Ответ: Е2=0; Е3=0,407∙10-23Дж.
Задача №4.
Даны два шарика массой 1г. Какой заряд нужно сообщить каждому шарику, чтобы сила взаимного отталкивания снарядов на шариках уравновесила гравитационную притяжения шариков?
Дано:
m=0,001 кг
ε0=8,85∙10-12Ф/м
G=6,67∙10-11 Н∙м2∙кг-2
Найти:
q -?
Решение:
Кулоновская сила электростатического притяжения зарядов определяется по формуле:

r – расстояние между шариками с зарядом q.
Гравитационная сила взаимодействия шариков определяется по формуле:
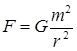
В состоянии равновесия получим:

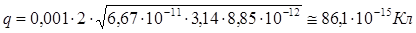
Ответ: 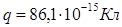 .
.
Задача №5
Проводник длиной 0,1м находится в однородном магнитном поле с индукцией 20 мТл. Определить силу, действующую на проводник, если сила тока в нем 3А, а угол между направлением тока и магнитной индукцией 30є.
Дано:
l=0,1 м
I=3 А
B=20∙10-6Тл
α=30є
Найти:
FА -?
Решение:
Сила Ампера, действующая на проводник, определяется по формуле:
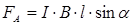
α – угол между векторами dl (направление тока) и В.
Получим:

Ответ:  .
.
Задача №6
Жесткость пружина рессоры вагона 481 кН/м. Масса вагона с грузом 64т. Вагон имеет четыре рессоры. При какой скорости вагон начнет сильно раскачиваться вследствие толчков на стыках рельс, если длина рельс 12,8м?
Дано:
k=481∙103 Н/м
m=64000 кг
l =12,8 м
Найти:
V -?
Решение:
Рассмотри колебание рессор как колебания пружинного маятника, циклическая частота колебания которого равна для каждой рессоры:

Тогда скорость, при которой вагон начнет сильно раскачиваться вследствие толчков на стыках рельс равна:

Получим:

Ответ:  .
.
Задача №7
На мыльную пленку (n=1,3) падает нормально пучок лучей белого света. Какова минимальная толщина пленки, если в отраженном свете она представляется красной (λ=7000Е)?
Дано:
n=1,3
λ=7000Е=7∙10-7 м
i=90є
Найти:
d -?
Решение:
Минимальную толщину пленки определим из выражения:

Ответ:  .
.
Задача №8
Для улучшения цвета белья на фабриках-прачечных его обрабатывают 0,3-% раствором ультрамарина в воде. Рассчитать теоретический расход ультрамарина для обработки 1 т белья, если расход раствора 0,6 л на 1 кг белья.
Дано:
n=0,3%
Gр=0,6 л/кг
M=1000 кг
Найти:
mультр -?
Решение:
Определим массу раствора, исходя из того, что плотность низконцентрированного раствора равна плотности воды ρ=1 кг/л:
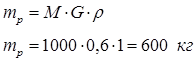
По заданной массовой концентрации n=0,03% получим теоретический массовый расход ультрамарина для обработки 1 т белья:

Ответ: 
Задача №9
Вычислите эквивалент Н3РО4 в реакциях с КОН при образовании следующих солей: КН2РО4, К2НРО4, К3РО4.
Решение
Запишем соответствующие реакции:

Эквиваленты Н3РО4 определим по формуле:

По стехиометрическим коэффициентам реакций получим:
для реакции (1):  ;
;
для реакции (2): 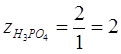 ;
;
для реакции (3):  .
.
Задача №10
Вычислите РН 0,35%-ного раствора NaOH, считая α=1 и ρ=1 г/мл.
Решение
Известно, что для комнатной температуры воды 22°С концентрация ионов водорода [H+] равна 10-7 моль/л. При α=1 и ρ=1 г/мл и концентрации 0,35% концентрация ионов водорода составит 0,9965·10-7 моль/л. Тогда водородный показатель раствора будет равен:

Так как концентрация раствора очень низкая, то показатель рН=7,0015 очень близок к нейтральному положению равному 7.
 2020-01-14
2020-01-14 627
627







