ПЕПТИДЫ И ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 Понятие о пептидах. Их строение
1.2 Номенклатура пептидов
1.3 Основной принцип пептидного синтеза
1.4 Экспериментальные методы создания пептидной связи
1.5 Первичная структура белка
1.6 Экспериментальное определение первичной структуры белка
ВЫВОДЫ
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
Пептиды и белки представляют собой высокомолекулярные органические соединения, построенные из остатков α-аминокислот, соединенных между собой пептидными связями.
Ни один из известных нам живых организмов не обходится без белков. Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д. Как видно, функции белков в природе универсальны. Белки входят в состав мозга, внутренних органов, костей, кожи, волосяного покрова и т.д. Основным источником α - аминокислот для живого организма служат пищевые белки, которые в результате ферментативного гидролиза в желудочно-кишечном тракте дают α - аминокислоты. Пептиды и белки различают в зависимости от величины молекулярной массы. Условно считают, что пептиды содержат в молекуле до 100 (соответствует молекулярной массе до 10000), а белки - свыше 100 аминокислотных остатков (молекулярная масса от 10000 до нескольких миллионов). При этом в пептидах различают олигопептиды, содержащие в цепи не более 10 аминокислотных остатков, и полипептиды, содержащие до 100 аминокислотных остатков.
ЛИТЕРАТУРНЫЙ ОБЗОР
Понятие о пептидах. Их строение
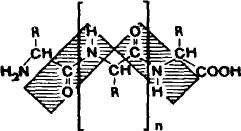
Пептиды — это цепочечные молекулы, содержащие от двух до ста остатков аминокислот, соединенных между собой амидными (пептидными) связями.
|
|
Рис.1 Строение пептида
Термин «пептиды» был предложен известным химиком Эмилем Фишером (1852—1919 гг.). Слово образовано из первых четырех букв названия пептоны (продукты расщепления белков пепсином) и конечных букв названия углеводов полисахариды.
По размеру молекулы и своим свойствам пептиды стоят между высокомолекулярными белками и аминокислотами. Наиболее распространены линейные пептиды, однако известны также циклические пептиды, молекулы которых могут иметь различные размеры. Циклические пептиды образуются из линейных, когда пептидная связь связывает амино- и карбоксильную функцию N- и С-концевых аминокислот.

Полинг и Кори в 1951 г. показали с помощью рентгеноструктурного анализа аминокислот, амидов аминокислот и простых линейных пептидов, что пептидная связь С—N укорочена по сравнению с нормальной простой связью (рис. 2).
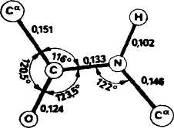
Рис. 2. Средние расстояния между атомами (нм), образующими пептидную связь и углы между связями.
Вследствие мезомерии получаются две устойчивые плоские конформации, транс (1) и цис (2), при затрудненном свободном вращении около связи С—N:
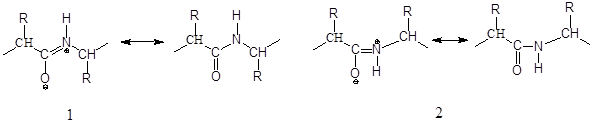
Рис.3 транс (1) и цис (2) пептиды
В 2,5-дикетопиперазинах, простейших циклических пептидах, построенных из двух аминокислот, имеются цис-пептидные связи. Циклические трипептиды могут существовать без напряжения также только с тремя цис-пептидными связями. Поскольку пролин и саркозин не обладают возможностью стабилизации транс-пептидиой связи, то можно легко синтезировать циклический трипептид — циклотрипролил. В нативных пептидах и белках преобладает транс-пептидная связь. В некоторых белках были найдены также и цис-пептидные связи, при этом в образовании пептидной связи всегда участвовал пролин [1].
 2020-01-14
2020-01-14 145
145