а) Взаимодействие алюминия и железа с разбавленными H2SO4 и HNO3
В 2 пробирки поместите небольшие кусочки металлов: в первую – алюминий, во вторую – железную стружку. Добавьте в каждую пробирку 2-4 мл раствора разбавленной серной кислоты H2SO4(разб.). Обратите внимание на отсутствие признаков реакции в пробирке с алюминием и на интенсивное выделение газа (Н2) в пробирке с железной стружкой (При необходимости подогрейте раствор). Чем это можно объяснить? Для установления степени окисления железа добавьте в пробирку с H2SO4 (разб.) 1-2 капли железосинеродистого калия K3[Fe(CN)6]. Появление синего окрашивания свидетельствует о том, что после взаимодействия железо имеет степень окисления +2(Fe2+). Запишите уравнение реакции взаимодействия алюминия и железа с разбавленной серной кислотой.
Не проводя эксперимента, исходя из теоретических положений, объясните, как изменятся процессы, если вместо разбавленной серной кислоты использовать разбавленную азотную кислоту HNO3 (разб.)? По какому признаку можно судить о протекании реакций взаимодействия? Что является окислителем в этом случае? Установите, какой газ должен выделяться в обеих пробирках, учитывая, что алюминий и железо отличаются по химической активности. Следует помнить, что при взаимодействии железа с разбавленной азотной кислотой образуется нитрат железа со степенью окисления железа +3(Fe3+). Объясните почему? Какой реактив можно использовать в качестве индикатора на ионы Fe3+? Ответы должны быть обоснованными.
Запишите уравнения реакций взаимодействия алюминия и железа с кислотами в полном молекулярном виде и расставьте коэффициенты.
б) Взаимодействие алюминия и железа с концентрированными кислотами H2SO4 и HNO3 (Опыт необходимо проводить в вытяжном шкафу)
Небольшой кусочек алюминия предварительно обработайте раствором NaOH для удаления оксидной пленки. Затем быстро поместите кусочек алюминия в химический стаканчик с раствором HCl. Наблюдаете интенсивное выделение водорода, свидетельствующее о взаимодействии алюминия с раствором соляной кислоты. С помощью пинцета достаньте алюминий из стаканчика (раствор HCl не выливайте), промойте его дистиллированной водой и быстро поместите его в раствор с H2SO4 (конц.). Объясните, почему в результате взаимодействия выделяется газ с резким запахом (SO2). Что появилось на поверхности алюминия? Через 2-3 мин. достаньте гранулу алюминия, быстро промойте водой и вновь опустите в стаканчик с раствором HCl. Почему отсутствуют признаки реакции? Почему не выделяется водород? Какие продукты реакции образуются в данном случае? Ответ должен быть обоснованным с написанием соответствующих реакций.
В пробирку поместите железную стружку и добавьте серную кислоту H2SO4(конц.). Что наблюдаете? Объясните, почему выделяется газ с резким запахом (SO2). Слейте раствор серной кислоты, промойте стружку дистиллированной водой и тщательно осмотрите ее поверхность. Опустите железную стружку в раствор – CuSO4. Выделяется ли медь на поверхности железной стружки? Если нет, то объясните почему? Ответ должен быть обоснованным.
Не проводя эксперимента, исходя из теоретических положений, объясните, изменятся ли процессы, если вместо H2SO4(конц.) использовать HNO3(конц.)? Почему должен выделяться бурый газ – NO2?. Запишите уравнения реакций взаимодействия железа с кислотами, учитывая, что в концентрированных кислотах железо пассивируется, т.е. появляется пленка Fe2O3 темно красного или черного цвета.
В) Взаимодействие алюминия и железа со щелочами
В две пробирки поместите кусочки металлов: в одну – алюминий, во вторую – железную стружку. Добавьте в обе пробирки 3-4 мл дистиллированной воды. Обратите внимание на отсутствие признаков реакции и объясните почему? Добавьте в обе пробирки 4-5 мл 2н раствора NaOH. Осторожно встряхните пробирки. Что наблюдаете? Почему в пробирке с алюминием происходит интенсивное выделение водорода, а в пробирке с железной стружкой отсутствуют признаки реакции? Какие металлы взаимодействуют со щелочами? Запишите уравнение реакций взаимодействия алюминия с раствором щелочи.
При оформлении отчета сделайте обстоятельный вывод о химическом взаимодействии алюминия и железа со сложными окислителями. Какие среды являются более опасными для алюминия и железа? Кратко опишите физические свойства алюминия и железа, применение их в электронной технике.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Почему при взаимодействии активных металлов с H2SO4(конц.) и H2SO4(разб.) образуются различные продукты?
2. Можно ли получить водород при воздействии на металлы разбавленной или концентрированной HNO3? Ответ должен быть обоснованным.
3. Что такое явление пассивации? Почему концентрированные кислоты H2SO4 и HNO3 можно хранить в железных емкостях, а разбавленные – нельзя? Ответы подтвердите написанием соответствующих реакций.
ЛИТЕРАТУРА
1. Коровин, Н. В. Общая химия / Н. В. Коровин. – М.: Высш. шк., 2000.
2. Фролов, В. В. Химия / В. В. Фролов. – М.: Высш. шк., 1986.
3. Химия: учеб.-метод. пособие для студ. всех спец. БГУИР заоч., веч. и дист. форм обуч. В 2 ч. Ч. 2 / И. В. Боднарь [и др.]. – Минск: БГУИР, 2005.
Лабораторная работа № 2
ПОЛУЧЕНИЕ И СВОЙСТВА
КОНСТРУКЦИОННЫХ МАТЕРИАЛОВ
Цель работы: на конкретных примерах ознакомиться с методами получения металлов и их свойствами.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Металлы и сплавы являются основным конструкционным материалом для машиностроения и приборостроения. К ним относятся химические элементы, простые и сложные вещества, обладающие характерными признаками:
1) низкой величиной относительной электроотрицательности, как следствие низких потенциалов ионизации и низкого сродства к электрону;
2) образуют только положительные центры;
3) в сложных ионах образуют также положительные центры.
Металлы и сплавы обладают рядом общих свойств. У атомов металлов на внешних электронных уровнях содержится небольшое количество электронов. Вследствие малой плотности электронов атомы металлов в процессе кристаллизации легко сближаются и обобществляют электроны. При перекрывании внешних орбиталей электроны мигрируют от одного атома к другому, осуществляя металлическую связь. В электрическом поле обобществленные электроны получают направленное движение и возникает электрический ток.
Для металлов характерна высокая теплопроводность, непрозрачность, металлический блеск, твердость, пластичность, способность (за исключением Hg) кристаллизоваться с образованием кристаллической решетки высокой симметрии: объемноцентрированный куб (о.ц.к.) (Nb, Ta, Pb, Cr и др.), гранецентрированный куб (Cu, Ni, Fe, Al, Ag, Au и др.), гексагональная плотная упаковка (Mg, Be, Cd, Zn, Ti, Zr и др.). Металлы могут быть легкими (для Li ρ = 0,5 г/см3) и тяжелыми (для Os ρ = 28 г/см3), легкоплавкими (для Hg – минус 390C, для Ga – 300C) и тугоплавкими (для W – 33900C). Для некоторых металлов характерно явление полиморфизма.
В зависимости от положения в периодической таблице (степени заполнения внешних и предвнешних уровней) все металлы делятся на s-, p-, d- и f- металлы.
Большинство металлов в природе находится в виде соединений с другими элементами. Только немногие металлы встречаются в природе в свободном состоянии, например Au, Hg, Ag, Pt, Cu (отчасти). Минералы и горные породы, содержащие соединения металлов в виде, пригодном для получения промышленным путем называются рудами.
Руды содержат металлы в виде оксидов, сульфидов, сульфатов, карбонатов, силикатов. галоидных соединений. Если в руде содержатся несколько металлов, то такие руды называются полиметаллическими.
Все методы получения металлов сводятся к процессу восстановления их из ионного состояния:
Меn+ + ne → Me0.
Основные способы получения металлов:
1. Вытеснение металла из его соединений более активным металлом (имеющим меньшее значение электродного потенциала (см. ряд напряжений)). Этот процесс может протекать в водных растворах – гидрометаллургия, а также в расплавах при высоких температурах – металлотермия. Впервые такой процесс был осуществлен при применении порошка алюминия для восстановления других металлов – алюмотермия. Al, Mg, Ca, Na отличаются высокой химической активностью и могут вытеснять другие металлы из их оксидов или соединений:
Cr2O3 + 2Al → 2Cr + Al2O3;
TiCl4 + 4Na → 4NaCl + Ti.
2. Восстановление металлов из их соединений газообразными СО и Н2 в присутствии твердого угля. Этот процесс осуществляется только при высоких температурах и называется пирометаллургией:
t,°C
MeO + CO → Me + CO2.
Данный процесс для некоторых металлов может сопровождаться образованием карбидов, тогда в качестве восстановителя используют водород:
t,°C
WO3 + 3H2 → W + 3H2O.
3. Электрометаллургия (электролиз) – разложение соединений под действием электрического тока. Данный процесс можно вести в водных растворах, а также в расплавах при повышенных температурах. Такой способ применим для получения металлов любой активности, но только из соединений ионного типа.
Пример. Схема электролизной системы и уравнения электродных процессов для получения цинка:
а) на графитовых электродах
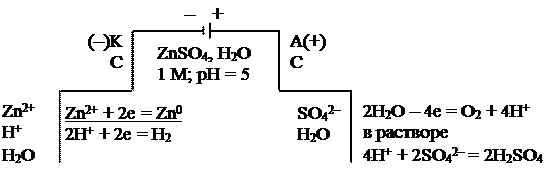 |
Суммарное уравнение электролиза:
2ZnSO4 + 2H2O = 2Zn + O2 + 2H2SO4
б) на цинковых электродах
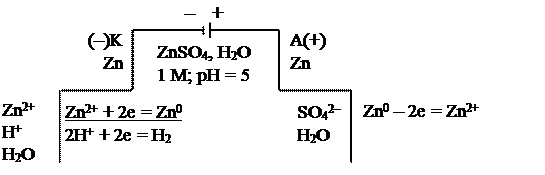 |
Схема электролиза на растворимых электродах (б) используется для:
– очистки металлов от примесей (электрорафинирование). В этом случае металл с примесями подключают к плюсу (+) внешнего источника (анод), к минусу (–) подключают чистый металл (катод), в качестве электролита используют водный раствор хорошо растворимой соли этого же металла;
– анодного травления (полировки) металлов и изделий из них. К плюсу (+) подключают изделие, требующее обработки;
– для получения покрытий. Изделие в данном случае подключают к минусу (–) внешнего источника тока (катод).
Для получения активных металлов проводят электролиз расплавов:
 |
Суммарное уравнение электролиза:
4KOH → 4K + O2 + 2H2O(г)
Алюминий самый распространенный металл в земной коре (его содержание составляет ~ 8,8%), весьма активен (φ0Al3+/Al = – 1,67 В), поэтому в природе в свободном состоянии не встречается, а находится в виде соединений: бокситов Al2O3хH2O, алюмосиликатов K2O Al2O3 6SiO2 и т.д. Металлический алюминий – легкий металл, он почти в 3 раза легче железа, лучший проводник тепла и электричества после серебра и меди. Алюминий в технике получают электролизом расплава смеси, состоящей из чистого Al2O3 и криолита Na3[AlF6] при температуре 900-9500С. В расплаве Al2O3 диссоциирует на ионы:
Al2O3 → Al3+ + AlO33–.
На катоде выделяется алюминий, а на аноде разряжаются анионы и окисляют графитовые электроды:
2AlO33– – 6е = Al2O3 + 3О (на аноде);
3О + 3С = 3СО↑;
4Al3+ + 12е = 4Al (на катоде).
Алюминий устойчив на воздухе, в горячей и холодной воде. Не растворяется в концентрированных серной Н2SO4 и азотной HNO3 кислотах, так как на его поверхности образуется тонкая и очень прочная пленка Al2O3. Однако оксид алюминия Al2O3 проявляет амфотерные свойства, то есть взаимодействует с кислотами и щелочами:
Al2O3 + 6НCl = AlCl3 + 3H2O;
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4].
Алюминий, лишенный оксидной пленки, весьма активен и взаимодействует с водой и разбавленными кислотами.
Алюминий – один из наиболее применяемых металлов в современной технике. Его используют как простое вещество, так и в разнообразных сплавах и соединениях. В частности, его сплав с магнием применяют как конструкционный материал для низкотемпературных ядерных реакторов. Будучи хорошим проводником электричества, применяется для изготовления электрических кабелей в различных электрохимических приборах. Алюминий не токсичен и находит широкое применение в пищевой и фармацевтической промышленности.
При протекании физико-химических процессов взаимодействия между металлами и растворами электролитов в ряде случаев могут протекать реакции вытеснения металлов из их соединений более активными металлами.
В результате на поверхности металлов осаждаются другие металлы, что приводит к образованию микрогальванических элементов, в которых металл с меньшим значением электродного потенциала φ0Me/Men+ является анодом, с большим значением φ0Me/Men+ – катодом. Такие процессы приводят, в конечном счете, к электрохимической коррозии активных металлов.
Несмотря на большое количество металлов (их более 80) свойства их не могут удовлетворить запросы новейшей техники. Поэтому в ряде случаев используются их смеси, находящиеся в расплавленном состоянии, при охлаждении которых образуются сплавы. В зависимости от характера и условий взаимодействия сплавы могут представлять собой механическую смесь кристаллов отдельных металлов, твердые растворы или химические соединения (интерметаллиды).
Пользуясь химическими методами можно установить качественный состав сплава. Для обнаружения катионов или анионов в сплаве их переводят с помощью аналитических (качественных) реакций в характерные осадки, или в растворимые окрашенные соединения, или в летучие соединения со специфическим запахом. Однако необходимо иметь в виду, что аналитические реакции указывают на наличие или отсутствие того или иного иона лишь при соблюдении определенных условий: концентрации раствора, реакции среды, температуры, времени.
Для обнаружения меди в сплаве необходимо нанести на образец 1-2 капли HNO3, затем через минуту нанести на это же место несколько капель раствора NH4OH. Синее окрашивание указывает на присутствие меди в сплаве.
Свинец в сплаве можно обнаружить действием концентрированной азотной кислотой (для перевода свинца в ионное состояние). Затем провести качественную реакцию с иодидом натрия или калия:
Pb2+ + 2I– → PbI2↓.
На поверхности сплава образуется соединение PbI2 желтого цвета.
Олово, находящееся в техническом припое, при действии концентрированной HNO3 образует белый осадок H2SnO3.
Реактивом на ионы Fe2+ является гексацианоферрат калия К3[Fe(CN)6]. Реакция сопровождается образованием турнбулевой сини:
3Fe2+ + 2[Fe(CN)6]3– → Fe3[Fe(CN)6]2.
турнбулевая синь
Для установления наличия ионов Fe3+ необходимо добавить роданид калия или аммония KCNS (NH4CNS). Образование роданида железа Fe(CNS)3 сопровождается окрашиванием раствора в красный цвет.
Для обнаружения серы в чугуне или стали, которая содержится в виде сульфидов FeS и других соединений, необходимо подействовать концентрированной 6н НCl и слегка подогреть. Выделение газа Н2S свидетельствует о наличии в сплаве серы. Если к выделяющемуся газу поднести фильтровальную бумагу, смоченную ацетатом свинца (СН3СОО)2Pb, то образование соединения PbS (черного цвета) подтверждает факт нахождения серы в исходном сплаве.
 2020-04-07
2020-04-07 320
320








