Весьма важной и крайне интересной является проблема взаимного влияния атомов, непосредственно не связанных друг с другом, а разделенных системой простых связей. В таких системах взаимное влияние атомов осуществляется индукционным путем. Для того чтобы составить общее представление о характере такого влияния, сравним, например, следующие три системы:

Если X — электроотрицательный атом или электроотрицательная группа атомов, то связь X—С поляризована так, что X является отрицательным концом диполя, а углерод — положительным. Так как углерод несет некоторый положительный заряд, то электронная пара, связывающая его с соседним атомом углерода, смещается по направлению к первому С-атому, что в свою очередь вызывает оттягивание электронной пары от атома (или группы атомов) А. Обычно такого рода взаимное влияние атомов (X и А) изображают следующим образом:


Благодаря индукционному влиянию атома X отрыв атома А в виде катиона в системе I происходит легче, чем в системе II.
Если Y — электроположительный атом (или группа атомов), то он оказывает противоположное индукционное влияние:
В этом случае разрыв связи С—А с образованием аниона А в системе III облегчен, сравнительно с системой II.
Область явлений, относящихся к взаимному влиянию атомов, непосредственно не связанных друг с другом, весьма обширна. Наиболее характерным примером является различие в силе кислот и оснований, например различная сила жирных кислот при замещении одного из атомов водорода в углеводородной цепи на F, Cl, Br, J, NO2, CN, СН3 и др. Так, константы диссоциации замещенных уксусных кислот показывают, что галоиды, непосредственно не связанные с атомом водорода карбоксильной группы, оказывают на него влияние, отличное в каждом конкретном случае.
Ярким примером подобного взаимного влияния у спиртов служит различие свойств триметилкарбинола и трифторметилдиметилкарбинола:

В то время как первый представляет собой один из наименее кислых спиртов, второй является кислотой, вытесняющей угольную кислоту из ее солей.
Характерной особенностью индукционного влияния является то, что оно быстро ослабевает, «затухает» вдоль цепи простых связей.
Если атом или группа атомов обладают электроотрицательным характером, они несколько оттягивают электронную пару от соседнего атома, что вызывает последовательно убывающее индукционное смещение электронных пар других связей в том же направлении (как в хлоруксусной кислоте). В таком случае говорят, что атом или группа атомов проявляет отрицательный индукционный эффект (-I). Если же, наоборот, атом или группа атомов отталкивают электронную пару, то они проявляют положительный индукционный эффект (+I).
Изучение силы различных замещенных кислот позволяет расположить заместители по их индукционному эффекту в следующий ряд:

Индукционный эффект водорода принят за нуль. Он выбран за основу для сравнения с ним других атомов и групп атомов.
Следует отличать статический и динамический индукционные эффекты. Статический индукционный эффект (обозначаемый символами I или Is) только что рассмотрен. Если же индукционный механизм обусловливает поляризуемость электронного облака в реагирующей молекуле, то такое электронное смещение называется индуктомерным эффектом и обозначается символом Id.
Сопряжение связей
В молекулах алифатических соединений, содержащих сопряженные связи, а также в ароматических молекулах взаимное влияние атомов осуществляется преимущественно другим путем, качественно отличающимся от индукционного взаимного влияния атомов. Для того чтобы уяснить характер такого влияния, рассмотрим, например, свойства систем с сопряженными двойными связями в жирных соединениях.
Среди химических особенностей систем с двумя сопряженными двойными связями наиболее характерным является протекание реакций 1,4-присоединения. В таких реакциях атакующие молекулы или их части (ионы, радикалы) присоединяются к крайним (первому и четвертому) атомам сопряженной системы, причем между вторым и третьим атомами возникает новая двойная связь, например:

Кроме того, в целом такие системы более реакционноспособ-ны (в первую очередь за счет повышенной реакционной способности первого и четвертого атомов) и могут вступать в реакции, не свойственные молекулам с изолированными двойными связями. Таково восстановление систем

водородом в момент выделения, присоединение к системам С=С—С=С щелочных металлов и их металлоорганических соединений, присоединение анионов CN-, SO3H- и R- (при действии RMgX) к четвертому (углеродному) атому системы О=С—С=С и др.
Таким образом, химические свойства сопряженных систем показывают, что содержащиеся в них двойные связи отличаются от изолированных двойных связей. Это отличие обусловлено особым характером взаимного влияния ненасыщенных атомов сопряженных систем. Такой специфический вид взаимного влияния атомов, качественно отличный от индукционного влияния, может быть интерпретирован как результат взаимодействия π-электронов двух или нескольких сопряженных двойных связей. Вследствие этого такой вид взаимного влияния атомов предложено называть сопряжением связей.
Молекулы с сопряженными двойными связями характеризуются и некоторыми физическими особенностями, например повышенной энергией образования сравнительно с молекулами, имеющими изолированные двойные связи, некоторым выравниванием межатомных расстояний и высокой поляризуемостью электронной системы связей. Физические показатели такого рода характеризуют строение нереагирующей молекулы, а следовательно, Они указывают на то, что сопряжение двойных связей представляет собой фактор, находящий свое отражение и в нереагирующей молекуле. Результат сопряжения связей в нереа-лирующей молекуле предложено называть статическим эффектом сопряжения или мезомерным эффектом.
Как мы уже указывали, природу сопряжения двойных связей можно интерпретировать как результат большой подвижности π-электронов, смещение которых происходит во всей сопряженной системе в делом. Роль π-злектронной пары одной из связей сопряженной системы может играть необобщенная пара р-электронов таких атомов, как N, О, S и т. п. Для того чтобы отразить этот вид взаимного влияния в структурных формулах, смещения π-электронов обычно отмечают изогнутыми стрелками, проведенными, например, от кратной связи С = С к простой связи С—С или от атома с неподеленной парой р-электронов к простой связи в направлении смещения:

Рассмотрим в качестве примера молекулу ацетамида, в которой неподеленная пара электронов атома азота находится в
сопряжении с π-связью:



Распределение электронной плотности в молекуле ацетамида определяется конкуренцией атомов О и N в соответствии с их сродством к электрону. Смещение неподеленной пары электронов атома азота к атому углерода карбонильной группы является причиной понижения основных свойств аминогруппы ацетамида сравнительно с аминогруппой в амине
и вместе с тем причиной понижения электрофильной реакционной способности карбонильной группы (точнее — атома углерода этой группы) сравнительно, например, с карбонильной группой в альдегидах:
Этот пример ясно показывает, что под термином «сопряжение связей» в сущности понимается определенного рода взаимодействие электронных систем атомов, в первую очередь такое взаимодействие, в котором участвуют валентные электроны.
Представления о сопряжении связей являются дальнейшим развитием проблемы взаимного влияния атомов в молекулах. С их помощью удается уже в настоящее время понять и объединить большой круг явлений органической химии, казавшихся ранее совершенно обособленными и загадочными.
Необходимо еще раз отметить, что сопряжение связей следует понимать как проявление определенного рода взаимного влияния атомов.
Представления о сопряжении связей позволяет вскрыть характер взаимного влияния атомов и систематизировать имеющийся фактический материал. Было бы глубоко ошибочным отрывать вопрос сопряжения связей от проблемы взаимного влияния атомов.
Химическая связь есть только форма взаимодействия ато-моз и, естественно, не может рассматриваться независимо от самих атомов.
Структурные формулы
Изображенные выше схемы, отражающие порядок химической связи атомов, называются формулами строения или структурными формулами, в отличие от эмпирических формул, показывающих только, какое число ато мов каждого элемента входит в молекулу.
Обычно для изображения строения молекул применяют упрощенные структурные формулы, в которых связи с атомами водорода не показывают валентными черточками. Таким образок., строение двух изомерных веществ эмпирической формулы С4Н11 может быть сокращенно выражено следующими формулами:

Структурные формулы ряда углеводородов с эмпирическими формулами СН4, С2Н6, С3Н8, С4Н10 могут быть выведены с помощью следующего приема рассуждения. Если мы представим себе, что от молекулы метана СН4 отнят один атом водорода, то останется остаток, или радикал, метил —СН3, способный вступать в связь с одним атомом водорода или каким-либо иным одновалентным атомом, и, следовательно, его можно назвать одновалентным остатком. Согласно правилам валентности, метил может заместить атом водорода в метане, или, другими словами, два метила могут соединиться вместе, вследствие чего получится молекула структурной формулы СН3—СН3, или эмпирической формулы С2Н6, — молекула этана.
В молекуле этана можно отнять атом водорода от любого издвух составляющих эту молекулу радикалов (метилов) и получить новый одноатомный остаток — этил СН3—СН2—. Одноатомный этил можно соединить с одноатомным метилом или, что то же самое, заместить в молекуле этана атом водорода на метил, и тогда получится молекула С3Н8 строения СН3—СН2—СН3, т. е. молекула вещества, называемого пропаном.
В молекуле пропана можно отнять атом водорода или от одного из крайних углеродных атомов, или от среднего атома углерода и заместить его на метил. В обоих случаях получится вещество эмпирической формулы С4Н10, но в первом случае молекула будет обладать строением СН3—СН2—СН2—СН3 (бутан), а во втором случае
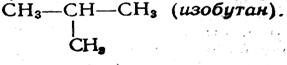
Продолжая рассуждения дальше, мы придем к выводу, что при замещении на метил атомов водорода в молекулах бутана и изобутана получится вещество с эмпирической формулой C5H12 {пептон), причем оказывается возможным существование трех изомеров:

При выводе возможных структурных формул следует иметь в виду, что эти формулы изображают только порядок связи атомов, а не пространственное их расположение и что поэтому формулы

выражают одно и то же строение вещества. Изображения

выражают также одно и то же вещество с одним и тем же химическим строением.
 2020-04-12
2020-04-12 136
136








