В соответствии с теорией гибридизации двойная связь образуется за счет перекрывания вдоль линии связи С-С sp² -гибридных орбиталей атомов углерода (σ -связь) и бокового перекрывания углеродных p -орбиталей (π -связь).
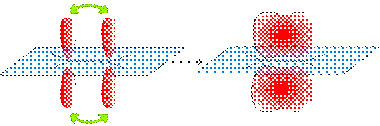
Схема образования связей в молекуле этилена
В состоянии sp² гибридизации электронное состояние атома углерода можно представить следующим образом:
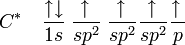
Все атомы этилена лежат в одной плоскости, а величина валентного угла связи C-H практически равна 120°. Центры углеродных атомов в этилене находятся на расстоянии 0,134 нм, то есть длина двойной связи несколько короче, чем С-С.
Согласно теории молекулярных орбиталей линейная комбинация двух атомных 2p -орбиталей углерода формирует две молекулярные π -орбитали этилена[1]:
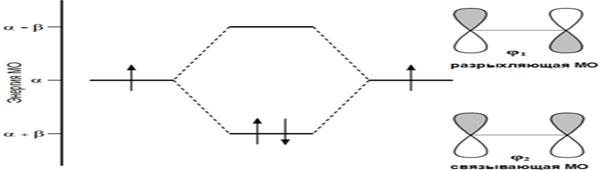
Формирование π -орбиталей этилена
Первый потенциал ионизации этилена составляет 10,51 эВ\, что позволяет электрону относительно легко уходить (электрофильное взаимодействие) с высшей занятой молекулярной орбитали (ВЗМО). В то же время, низшая связывающая молекулярная орбиталь (НСМО) этилена имеет достаточно низкую энергию: −1,6-1,8 эВ, что объясняет относительную легкость присоединения электрона с образованием аниона (нуклеофильное взаимодействие).
Добавление метильного заместителя снижает потенциал ионизации π - электронов примерно на 0,6-0,8 эВ и повышает энергию НСМО на 0,2 эВ, а ВЗМО на 0,7 эВ.
Физические свойства
- Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
- При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
| Физические свойства алкенов | |||||
| № | Название | Формула | Т плавления,°С | Т кипения,°С | Плотность, d204 |
| 1 | Этилен | С2H4 | −169,1 | −103,7 | 0,5700* |
| 2 | Пропилен | C3H6 | −187,6 | −47,7 | 0,5193* |
| 3 | Бутен-1 | C4H8 | −185,3 | −6,3 | 0,5951* |
| 4 | цис -Бутен-2 | CH3-CH=CH-CH3 | −138,9 | 3,7 | 0,6213 |
| 5 | транс -Бутен-2 | CH3-CH=CH-CH3 | −105,5 | 0,9 | 0,6042 |
| 6 | 2-Метилпропен-1 | CH3-C(CH3)=CH2 | −140,4 | −7,0 | 0,5942* |
| 7 | Пентен-1 | С5H10 | −165,2 | 30,1 | 0,6405 |
| 8 | Гексен-1 | С6H12 | −139,8 | 63,5 | 0,6730 |
| 9 | Гептен-1 | С7H14 | −119,0 | 93,6 | 0,6970 |
| 10 | Октен-1 | С8H16 | −101,7 | 121,3 | 0,7140 |
* Значения измерены при температуре кипения.
 2020-04-12
2020-04-12 476
476








