Простейшей двухосновной кислотой является кислота, молекула которой состоит из двух карбоксильных групп НООС—СООН, называемая щавелевой кислотой. Двухосновная кислота с тремя атомами углерода в молекуле — малоновая кислота — может иметь лишь одно строение: НООС—СН2—СООН. Последовательным замещением атомов водорода на метилы можно произвести от малоновой кислоты ряд кислот, являющихся непосредственными ее гомологами. Названия этих кислот обычно и производятся от названия малоновой кислоты:
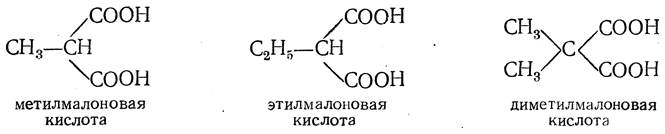
Метилмалоновой кислоте изомерна янтарная кислота строения НООС—СН2—СН2—СООН, поэтому метилмалоновую кислоту иногда называют изоянтарной кислотой. От янтарной кислоты, как и от малоновой, производится ряд ее непосредственных гомологов: метилянтарная, этилянтарная, две диметилянтарные кислоты и т. д.
Для двухосновных кислот, содержащих большее число атомов углерода в молекуле, также возможны изомеры, у которых карбоксильные группы находятся у крайних атомов углерода.
От каждой такой кислоты можно произвести ряд ее непосредственных гомологов.
Способы получения
Во многих случаях способы получения двухосновных кислот являются видоизменениями способов получения одноосновных кислот, причем оба карбоксила могут вводиться в молекулу одновременно или последовательно.
К числу реакций первого типа относятся следующие:
1. Окисление двупервичных г л и к о л е й или диальдегидов. Например, гликоль СН2ОН—СН2ОН и глиоксаль СНО—СНО при окислении дают щавелевую кислоту НООС—СООН.
2. Омыление динитрилов. Так, например, цианистый этилен при омылении дает янтарную кислоту:
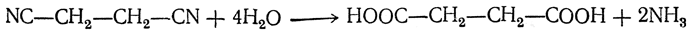
Примерами реакций второго типа являются следующие. 3. Окисление оксикислот с первичноспиртовой группой или альдегидокислот:
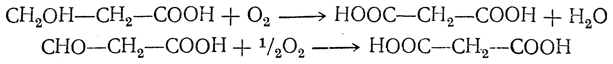
4. Омыление цианзамещенных кислот (мононитрилов двухосновных кислот). Так, например, омылением циануксусной кислоты получается малоновая кислота:
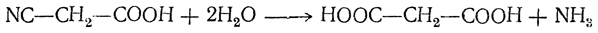
5. Деструктивное окисление. Двухосновные кислоты, как и одноосновные, часто образуются в результате энергичных реакций окисления, идущих с расщеплением молекулы органических веществ. Протекающие реакции, в зависимости от исходных веществ, могут быть отнесены к первому или ко второму типу.
Существуют также специальные синтетические способы получения высших двухосновных кислот из низших.
6. Электролиз солей кислых эфиров двухосновных кислот. Эта реакция аналогична синтезу предельных углеводородов путем электролиза солей жирных кислот. Продуктами реакции здесь являются средние эфиры высших двухосновных кислот:
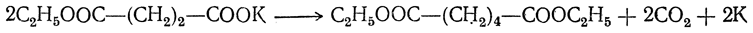
Этим путем из малоновой кислоты и ее гомологов можно получить янтарную кислоту и ее гомологи, из янтарной кислоты и ее гомологов — адипиновую и ее гомологи, из глутаровой кислоты — пробковую и т. д.
7. Синтезы с малоновым эфиром. Чрезвычайно важными синтезами двухосновных кислот являются синтезы при помощи сложных эфиров малоновой кислоты.
Двухосновные предельные кислоты представляют собой кристаллические вещества, растворимые в воде. Щавелевая кислота является сильной кислотой; с увеличением расстояния между карбоксилами константа электролитической диссоциации кислот падает. Все двухосновные кислоты являются более сильными кислотами, чем одноосновные с тем же числом атомов углерода.
В изменениях температур плавления двухосновных кислот, а также и в изменениях их растворимости наблюдается своеобразная периодическая закономерность. Температуры плавления кислот с четным числом атомов углерода в молекуле выше температур плавления двух ближайших кислот с нечетным числом атомов углерода. В общем, в ряду кислот с четным числом атомов углерода температуры плавления с повышением молекулярного веса понижаются, а в ряду кислот с нечетным числом — температуры плавления (если исключить малоновую кислоту) повышаются, и для обоих рядов они постепенно сближаются. Более высоким температурам плавления соответствует меньшая растворимость. С повышением молекулярного веса двухосновных кислот растворимость их в воде падает.
Химические свойства
Двухосновные кислоты могут давать два ряда солей, сложных эфиров, амидов и других производных.
Из реакций, характерных для двухосновных кислот, наиболее важными являются следующие:
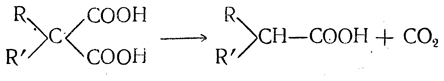
1. Отщепление карбоксила и превращение двухосновных кислот в одноосновные. Малоновая кислота и ее гомологи, у которых две карбоксильные группы связаны с одним и тем же атомом углерода, уже при простом нагревании легко отщепляют углекислоту. Таким образом из малоновой кислоты и ее гомологов получаются уксусная кислота и гомологи уксусной кислоты:
Щавелевая кислота также легко отщепляет СО2 с образованием муравьиной кислоты:
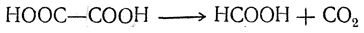
Остальные двухосновные кислоты, карбоксильные группы которых разделены большим числом атомов углерода, удерживают карбоксилы более прочно.
2. Образование циклических производных. Янтарная кислота при нагревании легко теряет молекулу воды с образованием циклического («внутреннего») ангидрида:
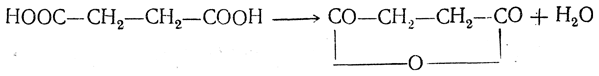
Еще легче отщепляют воду гомологи янтарной кислоты. Труднее отщепляет воду глутаровая кислота (несколько легче — ее гомологи); при этом также образуются циклические ангидриды
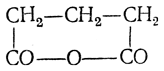
Ангидриды янтарных кислот содержат в кольце пять атомов, ангидриды глутаровых — шест ь атомов.
3. Реакции эфиров малоновой кислоты и синтезы с малоновым эфиром. В средних эфирах малоновой кислоты атомы водорода группы СН2 способны замещаться на металлы. Так, при действии натрия на этиловый эфир малоновой кислоты (обыкновенно называемый просто малоновым эфиром) можно получить продукты замещения одного или двух атомов водорода на атомы натрия, натриймалоновый эфир CHNa(COOC2H5)2 и динатриймалоновый эфир CNa2(COOC2H5)2 В однозамещенных производных малонового эфира типа R—СН(СООС2Н5)2 может замещаться на натрий лишь один атом водорода с образованием соединений R—CNa(COOC2H5)2. Двузамещенные производные типа R2C(COOC2H5)2 совершенно не способны к замещению водорода на натрий.
Способность малонового эфира давать металлические производные позволяет синтезировать при его помощи многочисленные кислоты различной основности.
Металлическим производным малоновых эфиров придают строение енолятов (аналогично производным ацетилацетона):

Реакции образования C-алкилзамещенных производных следует рассматривать как реакции присоединения галоидных алкилов по двойной связи, сопровождающиеся отщеплением NaHal, например:
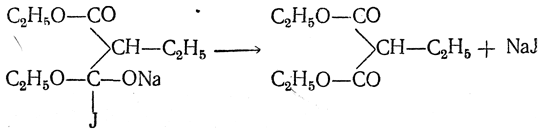
а) Синтез гомологов малоновой кислоты и одноосновных кислот действием иодистых алкилов (синтезы Конрада). При действии иодистых алкилов на натриймалоновый эфир натрий замещается на алкил и получаются моноалкилмалоновые эфиры, например:
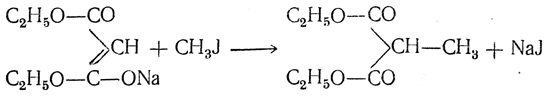
Если подействовать еще раз натрием и галоидным алкилом, можно получить диалкилмалоновые эфиры:
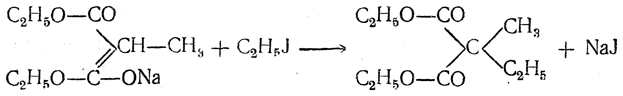
Так как гомологи малоновой кислоты при нагревании отщепляют СО2 и превращаются в предельные одноосновные кислоты, то этим способом можно с помощью малонового эфира синтезировать как саму уксусную кислоту, так и большое число ее гомологов, однозамещенных (т. е. жирных кислот нормального строения) и двузамещенных.
б) Синтез четырехосновных кислот и кислот ряда янтарной кислоты. При действии иода на натриймалоновый эфир и его гомологи два остатка малонового эфира соединяются в молекулу эфира четырехосновной кислоты:
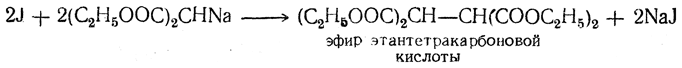
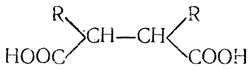
Так как правило о непрочности группировки двух карбоксилов, находящихся у одного и того же атома углерода, распространяется и на кислоты высшей основности, то из эфира этантетракарбоновой кислоты путем омыления и нагревания можно получить янтарную кислоту СН2(СООН)—СН2(СООН). Из гомологов натриймалонового эфира этим путем получаются симметрические гомологи янтарной кислоты
в) Синтез многоосновных кислот при помощи эфиров галоидзамещенных кислот. Действием на натриймалонозый эфир (и его гомологи) эфиров галоидзамещенных одноосновных кислот можно получить эфиры трехосновных кислот, а омылением этих эфиров с последующим отщеплением CO2 получаются двухосновные кислоты:
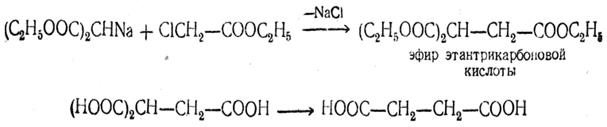
Этим путем могут быть получены и кислоты с большим расстоянием между карбоксильными группами, например:
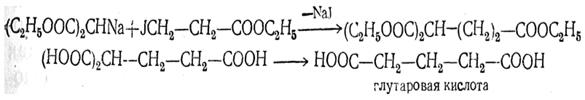
г) Синтез многоосновных кислот при помощи д и галоидных производных парафиновых углеводородов. При взаимодействии дигалоидных производных с натриймалоновым эфиром и его гомологами в реакцию вступают две молекулы натриймалонового эфира, например:
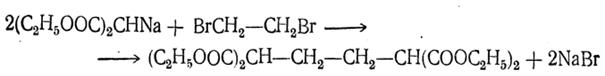
Отщеплением двух молекул двуокиси углерода от четырехосновной кислоты может быть получена двухосновная кислота (в данном случае адипиновая кислота).
Уже из сказанного видно, насколько разнообразны синтезы с помощью малонового эфира. Но возможен еще целый ряд синтезов, например при использовании соединений с ненасыщенными углеводородными радикалами, подобными аллилу, а также более сложных галоидных производных.
Синтезы с малоновым эфиром сыграли очень большую роль как при получении всевозможных органических кислот, так и при установлении этим путем их строения, и принадлежат к числу наиболее разработанных синтетических методов органической химии.
 2020-04-12
2020-04-12 304
304








