обеспечивается пассивной проницаемостью биологических мембран или же активным транспортом ионов за счёт работы так называемых молекулярных насосов, встроенных в мембраны клетки или субклеточных частиц. Роль Т. и. исключительно важна для нормальной жизнедеятельности всех живых организмов. Благодаря Т. и. в клетке осуществляется поддержание оптимальной концентрации ионов К+, Na+, Н+, Ca2+ и др., которая, как правило, резко отличается от концентрации ионов в окружающей среде. Разница концентрации (градиент) ионов K+, Na+, Ca2+ внутри и вне клетки лежит в основе передачи возбуждения в организмах; градиентов ионов Н+ на мембране клеточных органелл митохондрий и хлоропластов обеспечивает запасание энергии в клетке при окислении биологическом и фотосинтезе. Т. и. Ca2+ из мышечной клетки приводит к расслаблению мышц, поступление этих ионов в цитоплазму при возбуждении вызывает мышечное сокращение.
Поддержание градиента ионов на биологических мембранах осуществляется молекулярными насосами, работа которых обеспечивается, как правило, энергией, выделяемой при расщеплении АТФ. Расщепление АТФ при работе этих ферментов сопряжено с переносом соответственно ионов К+, Na+, Н+, Ca2+.
Для регуляции внутриклеточных процессов большое значение имеют Т. и. Ca2+, Na+ и др. в клетку и Т. и. К+ из клетки, вызванные увеличением проницаемости мембран для этих ионов в результате открывания пор или активирования переносчиков соответствующих ионов в мембране. Этот процесс может включаться под действием нервного импульса, медиаторов (например, ацетилхолина) и гормонов; действие последних на Т. и. часто бывает не прямым, а опосредованным активацией ферментов в мембране или биосинтеза белков в ядре и цитоплазме при помощи системы циклических нуклеотидов. Нарушение нормального Т. и. лежит в основе многих заболеваний (некоторые виды отравлений, нарушения водно-солевого обмена, нарушение функции органов при недостатке кислорода или нарушении кровообращения, нарушение секреции медиаторов и гормонов, действие радиации и т.д.). Поэтому изучение влияния различных веществ на Т. и. необходимо для разработки новых методов диагностики и лечения, а также для создания новых лекарственных препаратов.
Не зазубривать. Чисто прочитать и понять суть =*)
Электрохимический потенциал, термодинамическая функция, характеризующая состояние какого-либо компонента, состоящего из заряженных частиц (электронов, ионов), в фазе данного состава.
Электрохимический потенциал — физическая величина, связывающая химический потенциал (μ) и электрический потенциал (φ) некоторой электрохимической системы соотношением:
A = μ + e·φ
где А — работа, нарушающая электрохимическое равновесие системы; e — элементарный заряд частицы.
Зависимость потока ионов J от электрохимического градиента определяется уравнением Теорелла: 
где U - подвижность ионов, C - концентрация ионов, dμ/dx - электрохимический градиент.

Подставляя (6) в (7), можно получить уравнение Нернста-Планка с учётом двух градиентов, которые обуславливают диффузию ионов:

СМЫСЛ ЭТИХ УРАВНЕНИЙ???
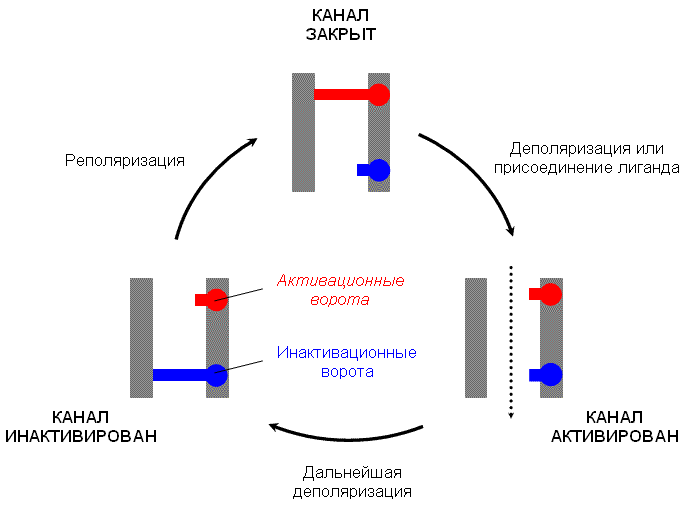
5. Ионные каналы — порообразующие белки (одиночные либо целые комплексы), поддерживающие разность потенциалов, которая существует между внешней и внутренней сторонами клеточной мембраны всех живых клеток. Относятся к транспортным белкам. С их помощью ионы перемещаются согласно их электрохимическим градиентам сквозь мембрану. Такие комплексы представляют собой набор идентичных или гомологичных белков, плотно упакованных в липидном бислое мембраны вокруг поры. Каналы расположены в плазмалемме и некоторых внутренних мембранах клетки.
Каждый тип каналов избирателен (селективен) для определенного иона и имеет для этого соответствующие размеры и строение пор. Например, в сердечных клетках некоторые каналы могут пропускать ионы натрия, другие специализированы для прохождения ионов калия, остальные — для ионов кальция.
Через ионные каналы проходят ионы Na+ (натрия), K+ (калия), Cl− (хлора) и Ca++ (кальция). Из-за открывания и закрывания ионных каналов меняется концентрация ионов по разные стороны мембраны и происходит сдвиг мембранного потенциала.
 Механизм транспорта сердечного натриевого канала:
Механизм транспорта сердечного натриевого канала:
Быстрая волна деполяризации (когда мембранный потенциал становится менее отрицательным), активизирует покоящиеся каналы для их открытия. В это время ионы Na+ быстро проникают в клетку — последовательный ток Na+ внутрь. В то же время активированные каналы остаются открытыми только на короткое время, несколько тысячных долей секунды, и затем спонтанно закрываются, переходя в неактивное состояние, которое отличается от закрытого состояния покоя (рис. 1.11В). В неактивном состоянии ионные каналы не могут перейти непосредственно в открытое состояние, так как ворота белкового канала заблокированы в результате процесса инактивации.
Неактивное состояние сохраняется до тех пор, пока потенциал мембраны не реполяризуется обратно до исходного уровня покоя. Пока происходит реполяризация, неактивные каналы предотвращают любое прохождение натриевых ионов. Поэтому при нормальной клеточной деполяризации потенциалзависимое быстрое прохождение ионов натрия через каналы происходит за короткий промежуток времени, затем каналы закрываются и находятся в таком состоянии до тех пор, пока не произойдет почти полная реполяризация клеточной мембраны.
6.. Активный транспорт — перенос вещества через клеточную или внутриклеточную мембрану или через слой клеток, протекающий против градиента концентрации из области низкой концентрации в область высокой, т. е. с затратой свободной энергии организма. В большинстве случаев, источником энергии служит энергия макроэргических связей АТФ.
Активный специфический транспорт неэлектролитов (молекулярный транспорт) реализуется с помощью нескольких типов молекулярных машин — насосов и переносчиков. Транспорт неэлектролитов (моносахаридов, аминокислот и других мономеров) может сопрягаться с симпортом — транспортом другого вещества, движение которого против градиента концентрации является источником энергии для первого процесса. Симпорт может обеспечиваться ионными градиентами (например, натрия) без непосредственного участия АТФ.
Мембранный насос, диафрагменный насос, диафрагмовый насос — объёмный насос, рабочий орган которого — гибкая пластина (диафрагма, мембрана), закреплённая по краям; пластина изгибается под действием рычажного механизма (механический привод) или в результате изменения давления воздуха (пневматический привод) или жидкости (гидравлический привод), выполняя эквивалентную функции поршня в поршневом насосе.
 Механизм: Стабильность градиента ионов достигается посредством активного транспорта: мембранные белки переносят ионы через мембрану против электрического и (или) концентрационного градиентов, потребляя для этого метаболическую энергию. Наиболее важный процесс активного транспорта - это работа Na/K-насоса, существующего практически во всех клетках; насос выкачивает ионы натрия из клетки, одновременно накачивая ионы калия внутрь клетки. Таким образом, обеспечивается низкая внутриклеточная концентрация ионов натрия и высокая – калия. Градиент концентрации ионов натрия на мембране имеет специфические функции, связанные с передачей информации в виде электрических импульсов, а также с поддержанием других активных транспортных механизмов и регулирования объема клетки.
Механизм: Стабильность градиента ионов достигается посредством активного транспорта: мембранные белки переносят ионы через мембрану против электрического и (или) концентрационного градиентов, потребляя для этого метаболическую энергию. Наиболее важный процесс активного транспорта - это работа Na/K-насоса, существующего практически во всех клетках; насос выкачивает ионы натрия из клетки, одновременно накачивая ионы калия внутрь клетки. Таким образом, обеспечивается низкая внутриклеточная концентрация ионов натрия и высокая – калия. Градиент концентрации ионов натрия на мембране имеет специфические функции, связанные с передачей информации в виде электрических импульсов, а также с поддержанием других активных транспортных механизмов и регулирования объема клетки.
7. мембранный потенциал -разность электрических потенциалов между наружной и внутренней поверхностями биологической мембраны, обусловленная неодинаковой концентрацией ионов, гл. обр. натрия, калия и хлора.
Биоэлектрические потенциалы — электрические потенциалы, возникающие в живых клетках и тканях; показатель биоэлектрической активности, определяемой разностью электрических потенциалов между двумя точками живой ткани.
Метод измерения М.П.: Разность потенциалов между внутренней и внешней средами клетки может измеряться непосредственно и довольно точно. Для этого используют микроэлектрод, представляющий собой стеклянную микропипетку с диаметром кончика до 1мкм, заполненную концентрированным раствором KCl. Микроэлектрод подключают к усилителю напряжения регистрирующего устройства. Можно измерять мембранный потенциал мышечных, нервных клеток или клеток других тканей. Другой электрод (референтный) установлен на поверхности ткани.
Когда кончик микроэлектрода находится вне клетки, его потенциал по отношению к референтному электроду равен нулю. Если конец электрода погружают в клетку, прокалывая плазматическую мембрану, разность потенциалов резко становится отрицательной. На шкале измерительного устройства регистрируется разность потенциалов между внутренней и внешней средами клетки. Эта разность потенциалов называется трансмембранной, или мембранным потенциалом
Пока электрод находится снаружи мембраны нервного волокна, регистрируется нулевой потенциал, соответствующий потенциалу внеклеточной жидкости. Затем при прохождении регистрирующего электрода через зону изменения напряжения на клеточной мембране (так называемый электрический дипольный слои) потенциал резко снижается до -90 мВ. Во время движения электрода через центр волокна величина потенциала остается на постоянном уровне -90 мВ, однако возвращается к нулю в момент прохождения электрода через мембрану на противоположную сторону волокна.
 2020-04-12
2020-04-12 288
288







