Периодический закон химических элементов был открыт русским ученым Д.И.Менделеевым в 1869 году.
Современная формулировка: свойства простых тел, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядра атома.
Периодическая система – это графическое изображение периодического закона, где по горизонтальной оси расположены периоды, по вертикальной оси – группы.
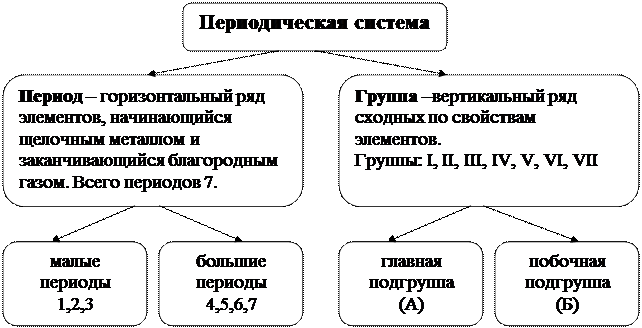
Для компактности и удобства пользования Периодической системой 14 элементов из 6-го периода, сходных по свойствам с лантаном и 14 элементов из 7-го периода, сходных с актинием вынесены в отдельный ряд за пределы таблицы.
Если в таблице провести диагональ от бора к астату, то в правом верхнем углу находятся типичные неметаллы, в левом нижнем углу – металлы, вдоль диагонали располагаются амфотерные элементы.
В Периодической системе, как правило, указаны формулы высших оксидов и летучих водородных соединений. Чтобы составить формулу нужно вместо буквы R подставить элемент в соответствии с номером группы. Например, азот N находится в V группе, высший оксид R2O5 – N2O5, летучее водородное соединение RH3 – NH3.
Свойства элемента и его соединений зависят от электронного строения атома. Атом состоит из ядра и электронов. Электрон (ē) – отрицательно заряженная частица. Количество электронов соответствует порядковому номеру химического элемента. Число электронов равно числу протонов
(ē = р+). Протоны- положительно заряженные частицы, определяют заряд ядра. Чтобы вычислить число нейтронов нужно из атомной массы вычесть число протонов (nº = Ar – p+). Нейтроны – нейтральные частицы.
Электроны вокруг ядра располагаются по энергетическим уровням, их количество соответствует номеру периода. Обозначаются 1,2,3,4.…
Энергетические уровни состоят из подуровней, s, p, d, f.
Распределение электронов по уровням и подуровням:
1уровень – 2ē 1s2
2 уровень – 8ē 2s22p6
3 уровень – 16ē 3s23p63d10
4 уровень – 32ē 4s24p64d104f14
План характеристики химического элемента по месту положения в П.С. Д.И. Менделеева:
1. Название, символ, период, группа, подгруппа
2. Порядковый номер, заряд ядра, количество протонов, электронов, нейтронов
3. Строение атома, электронная и графическая формула;
4. Возможные ковалентности
5. Металл, неметалл, амфотерный металл
6. Формула высшего оксида элемента, его характер (основный, кислотный, амфотерный)
7. Формула летучего водородного соединения.
Пример 1. Дать характеристику атома химического элемента лития по положению его в Периодической системе Д.И. Менделеева.
1. Мышьяк (As) ― элемент 4 периода V группы главной A подгруппы периодической системы Д. И. Менделеева.
2. Порядковый номер 33, заряд ядра +33, р+ = 33, ē = 33, nº = 74 – 33=31
3. +33 As)2)8)18)5
1s22s22р63s23p63d104s24p3 – электронная формула
графическое изображение
| 4 | ↑↓ | ↑ | ↑ | ↑ | |||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | d | ||||
| 1 | ↑↓ | p | |||||||
S
4. ковалентности - 3,5
5. не металл
6. высший оксид Аs2O5 – кислотный
7. летучее водородное соединение - AsH3
Контрольное задание № 3
Тема: «Периодический закон и периодическая система Д.И. Менделеева. Строение атома».
Дать характеристику атома химического элемента по положению его в Периодической системе Д.И. Менделеева.
Варианты заданий
| № вар-та | Хим. элемент | № вар-нта | Хим. элемент | № вар-нта | Хим. элемент |
| 1 | магний | 11 | никель | 21 | кобальт |
| 2 | кремний | 12 | А алюминий | 22 | хлор |
| 3 | сера | 13 | фосфор | 23 | ванадий |
| 4 | железо | 14 | селен | 24 | натрий |
| 5 | калий | 15 | хлор | 25 | никель |
| 6 | азот | 16 | медь | 26 | кремний |
| 7 | кальций | 17 | титан | 27 | бром |
| 8 | германий | 18 | фтор | 28 | хром |
| 9 | кислород | 19 | галлий | 29 | углерод |
| 10 | цинк | 20 | марганец | 30 | алюминий |
 2020-04-12
2020-04-12 362
362








