Изучаем тему: Классификация химических реакций в органической и неорганической химии,
Вам необходимо выполнить задания:
Изучить материал лекции
Лекция
 Виды химических реакций в неорганической химии:
Виды химических реакций в неорганической химии:
А) Классификация по количеству начальных веществ:
Разложение – вследствие данной реакции, из одного имеющегося сложного вещества, образуются два или несколько простых, а так же сложных веществ.
Пример: 2Н2O2 → 2Н2O + O2
Соединение – это такая реакция, при которой из двух и более простых, а также сложных веществ, образуется одно, но более сложное.
Пример: 4Al+3O2 → 2Al2O3
Замещение – это определенная химическая реакция, которая проходит между некоторыми простыми, а так же сложными веществами. Атомы простого вещества, в данной реакции, замещаются на атомы одного из элементов, находящегося в сложном веществе.
Пример: 2КI + Cl2 → 2КCl + I2
Обмен – это такая реакция, при которой два сложных по строению вещества обмениваются своими частями.
Пример: HCl + KNO2 → KCl + HNO2
Б) Классификация по тепловому эффекту:
Экзотермические реакции – это определенные химические реакции, при которых происходит выделение тепла.
Примеры:
S +O2 → SO2 + Q
2C2H6 + 7O2 → 4CO2 +6H2O + Q
Эндотермические реакции – это определенные химические реакции, при которых происходит поглощение тепла. Как правило, это реакции разложения.
Примеры:
CaCO3 → CaO + CO2 – Q
2KClO3 → 2KCl + 3O2 – Q
Теплота, которая выделяется или поглощается в результате химической реакции, называется тепловым эффектом.
Химические уравнения, в которых указан тепловой эффект реакции, называют термохимическими.
В) Классификация по обратимости:
Обратимые реакции – это реакции, которые протекают при одинаковых условиях во взаимопротивоположных направлениях.
Пример: 3H2 + N2 ⇌ 2NH3
Необратимые реакции – это реакции, которые протекают только в одном направлении, а так же завершающиеся полным расходом всех исходных веществ. При этих реакциях выделяется газ, осадок, вода.
Пример: 2KClO3 → 2KCl + 3O2 ↑
Г) Классификация по изменению степени окисления:
Окислительно - восстановительные реакции – в процессе данных реакций происходит изменение степени окисления.
Пример: Сu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O.
Не окислительно - восстановительные – реакции без изменения степени окисления.
Пример: HNO3 + KOH → KNO3 + H2O.
Д) Классификация по фазе:
Гомогенные реакции – реакции, протекающие в одной фазе, когда исходные вещества и продукты реакции имеют одно агрегатное состояние.
Пример: Н2(газ) + Cl2(газ) → 2HCL
Гетерогенные реакции – реакции, протекающие на поверхности раздела фаз, при которых продукты реакции и исходные вещества имеют разное агрегатное состояние.
Пример: CuO+ H2 → Cu+H2O
Классификация по использованию катализатора:
Катализатор – вещество, которое ускоряет реакцию. Каталитическая реакция протекает в присутствии катализатора, некаталитическая – без катализатора.
Пример: 2H202MnO2→ 2H2O + O2 катализатор MnO2
Взаимодействие щелочи с кислотой протекает без катализатора.
Пример: КOH + HCl → КCl + H2O
Ингибиторы – вещества, замедляющие реакцию.
Катализаторы и ингибиторы сами в ходе реакции не расходуются.
 Виды химических реакций в органической химии
Виды химических реакций в органической химии
Замещение – это реакция, в процессе которой происходит замена одного атома/группы атомов, в исходной молекуле, на иные атомы/группы атомов.
Пример: СН4 + Сl2 → СН3Сl + НСl
Присоединение – это реакции, при которых несколько молекул вещества соединяются в одну. К реакциям присоединения относятся:
- Гидрирование – реакция, в процессе которой происходит присоединение водорода по кратной связи.
Пример: СН3—СН = СН2 (пропен) + Н2 → СН3—СН2—СН3 (пропан)
- Гидрогалогенирование – реакция, присоединяющая галогенводород.
Пример: СН2 = СН2 (этен) + НСl → СН3—СН2—Сl (хлорэтан)
Алкины реагируют с галогеноводородами (хлороводородом, бромоводородом) так же, как и алкены. Присоединение в химической реакции проходит в 2 стадии, и определяется правилом Марковникова:
При присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода.
Механизм данной химической реакции. Образующийся в 1 - ой, быстрой стадии, p- комплекс во 2 - ой медленной стадии постепенно превращается в s-комплекс - карбокатион. В 3 - ей стадии происходит стабилизация карбокатиона – то есть взаимодействие с анионом брома:
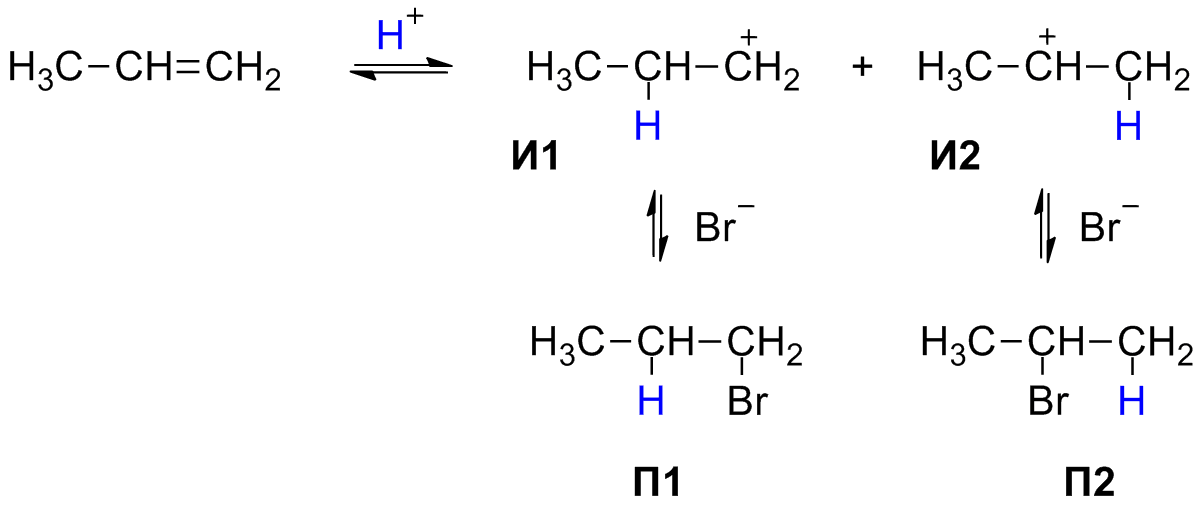
И1, И2 - карбокатионы. П1, П2 - бромиды.
Галогенирование – реакция, при которой присоединяется галоген. Галогенированием так же, называют все процессы, в результате которых в органические соединения вводятся атомы галогена. Данное понятие употребляется в "широком смысле". В соответствии с данным понятием, различают следующие химические реакции на основе галогенирования: фторирование, хлорирование, бромирование, йодирование.
Галогенсодержащие органические производные считаются важнейшими соединениями, которые применяются как в органическом синтезе, так и в качестве целевых продуктов. Галогенпроизводные углеводородов, считаются исходными продуктами в большом количестве реакций нуклеофильного замещения. Что касается практического использования соединений, содержащих галоген, то они применяются в виде растворителей, например хлорсодержащие соединения, холодильных агентов - хлорфторпроизводные, фреоны, пестицидов, фармацевтических препаратов, пластификаторов, мономеров для получения пластмасс.
Гидратация – реакции присоединения молекулы воды по кратной связи.
Полимеризация – это особый вид реакции, при которой молекулы вещества, имеющие относительную невеликую молекулярную массу, присоединяются друг к другу, впоследствии образовывая молекулы вещества с высокой молекулярной массой.
На основе материала лекции выполните2 тестовых задания, по вариантам как Вы сидите в учебном кабинете.
I-вариант
1. Дано уравнение реакции получения оксида азота (ΙΙ): N2 + O2 ↔ 2NO – Q
Дайте характеристику реакции по всем изученным вами классификационным признакам.
2. Соотнесите:
А) разложения, гетерогенная.
1) 2Al + 3H2SO4 → Al2(SO4)3+3H2↑
Б) соединения, гомогенная.
2) H2SO4 + BaCl2 → BaSO4 + 2HCl + Q
В) обмена, экзотермическая.
3) 2H2 + O2 → 2H2O
Г) замещения, окислительно - восстановительная.
4) 2 NaOH → Na2O + H2O
3. Приведите примеры образования оксида меди (П) в результате реакции:
1. соединения,
2. разложения.
4. Проставьте коэффициенты в следующих схемах реакции, определите к какому типу относиться каждая из них:
1. Al + O2 → Al2O3
2. CaO + HCl → CaCl2 + H2O
3. NaHCO3 → Na2CO3 + H2O + CO2↑
4. Mg + H2SO4 → MgSO4 + H2↑
5. К какому типу химической реакции относиться образование углекислого газа в результате:
1. взаимодействия угля с оксидом меди;
2. прокаливания известняка;
3. сжигания угля;
4. горения угарного газа?
6*. По каким внешним признакам можно судить, что произошла химическая реакция при взаимодействии следующих пар веществ:
1. K2S + Pb(NO3)2 →
2. FeCl3 + NaOH →
3. CuO + HNO3 →
1. Na2CO3 + HCl →
2. Ca(HCO3)2 →t
3. Zn + CuSO4 →
Завершите уравнения химических реакций, укажите названия образующихся веществ, расставьте коэффициенты и укажите, к какому типу реакций относиться каждая из них.
II-вариант
1. Дано уравнение реакции получения аммиака: N2 + 3H2 ↔ 2NH3 + Q
Дайте характеристику реакции по всем изученным вами классификационным признакам.
2. Соотнесите:
А) обмена, экзотермическая.
1) Zn + 2HCl → ZnCl2+H2↑
Б) замещения, окислительно - восстановительная.
2) H2S + 2NaOH → Na2S + 2H2O + Q
В) разложения, гетерогенная.
3) 2SO2 + O2 → 2SO3
Г) соединения, гомогенная.
4) 2Fe(OH)3 → Fe2O3 + 3H2O
3. Приведите примеры образования оксида углерода (IV) в результате реакции:
1. соединения,
2. разложения.
4. Проставьте коэффициенты в следующих схемах реакции, определите к какому типу относиться каждая из них:
1.
1. Na + O2 → Na2O
2. CaO + H3PO4 → Ca3(PO4)2 + H2O
3. Ca(HCO3)2 → CaCO3 + H2O + CO2↑
4. Al + HCl → AlCl3 + H2↑
5. К какому типу химической реакции относиться образование оксида железа(II) в результате:
1.
1. взаимодействия железного гвоздя с водой;
2. прокаливания гидроксида железа(II);
3. сжигания железных опилок в кислороде;
4. термическое разложение карбоната железа(II) без доступа воздуха?
6*. По каким внешним признакам можно судить, что произошла химическая реакция при взаимодействии следующих пар веществ:
4. K2SO4 + Ba(NO3)2 →
5. AlCl3 + KOH →
6. ZnO + HCl →
4. CaCO3 + H2SO4 →
5. NaHCO3 →t
6. Fe + AgNO3 →
Завершите уравнения химических реакций, укажите названия образующихся веществ, расставьте коэффициенты и укажите, к какому типу реакций относиться каждая из реакций.
Вариант 1.
1. Неверным является утверждение, что получение аммиака из азота – это процесс:
а) разложения; б) каталитический; в) обратимый; г) гомогенный.
2. Верно утверждение, что реакция нейтрализации – это реакция:
а) окислительно-восстановительная; б) обмена;
в) всегда обратимая; г) каталитическая.
3. Из перечисленных ниже процессов к химической реакции относится:
а) горение; б) кипение в) возгонка; г) плавление
4. Необратимой является реакция:
а) разложения угольной кислоты; б) получения сернистой кислоты из оксида серы(IV) и воды;
в) разложения гидроксида меди (П); г) получения аммиака из простых веществ.
5. К реакциям ионного обмена относится реакция между:
а) раствором гидроксида калия и соляной кислотой; б) магнием и серой;
в) цинком и соляной кислотой; г) раствором хлорида меди (II) и железом.
Вариант 2.
1. Гомогенной является реакция:
а) горение фосфора б) реакция между оксидом фосфора (V) и водой
в) окисление оксида азота (II) кислородом г) реакция между мелом и соляной кислотой
2. Верно утверждение, что реакция: Zn + 2 HCl = ZnCl2 + Н2
а) окислительно-восстановительная; б) обмена;
в) обратимая; г) каталитическая.
3. Из перечисленных ниже процессов к химической реакции не относится:
а) горение магния; б) ржавление железа
в) кипение воды; г) разложение карбоната кальция
4. Необратимой является реакция:
а) разложения угольной кислоты; б) получения сернистой кислоты из оксида серы (IV) и воды
в) разложения гидроксида цинка; г) получения аммиака из простых веществ.
5. К реакциям ионного обмена относится реакция между:
а) натрием и водой; б) железом и серой;
в) магнием и соляной кислотой; г) раствором хлорида бария и раствором сульфата натрия.
 2020-04-12
2020-04-12 304
304







