Расчет теплоты образования по энергиям связи
Этот метод применяется для расчета теплоты образования газообразных органических соединений. Расчет ведется по формуле
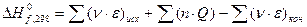
где ν – стехиометрические коэффициенты
ε – энергия связи, ккал/моль (кДж/моль)
n – число исходных твердых атомов
Q – теплота возгонки твердых элементов, ккал/моль (кДж/моль)
Пример 1: рассчитать теплоту образования газообразной уксусной кислоты
1. Запишем уравнение реакции образования 1 моль газообразной уксусной кислоты из простых веществ в стандартном состоянии:
2C(тв)+2Н2(г)+О2(г)=С2Н4О2(г)
Запишем все связи в газообразных простых веществах, учитывая стехиометрические коэффициенты:

Запишем количество атомов твердых элементов, умножив его на теплоту возгонки

2. Изобразим структурную формулу уксусной кислоты

Запишем все связи в веществе:

Примечание: группа –СООН считается как единое целое, вследствие значительной энергии сопряжения
3. Вычислим, подставив соответствующие величины из справочника:

Справочная величина: -434,84 кДж/моль [Краткий справочник физико-химических величин / под ред. А. А. Равделя, А. М. Пономарёвой. – 10-е изд., испр. и дополн. – СПб.: Иван Фёдоров, 2003. – 240 с.].
Пример 2: рассчитать теплоту образования газообразного нитрила акриловой кислоты:
Запишем уравнение реакции образования 1 моль газообразного акрилонитрила из простых веществ в стандартном состоянии:
2C(тв)+1,5Н2(г)+0,5N2(г)=С3Н3N(г)
Запишем все связи в газообразных простых веществах, учитывая стехиометрические коэффициенты:

Запишем количество атомов твердых элементов, умножив его на теплоту возгонки
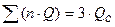
2. Изобразим структурную формулу акрилонитрила

Запишем все связи в веществе:

3. Вычислим, подставив соответствующие величины из справочника:

Справочная величина: 184,93 кДж/моль. [Краткий справочник физико-химических величин / под ред. А. А. Равделя, А. М. Пономарёвой. – 10-е изд., испр. и дополн. – СПб.: Иван Фёдоров, 2003. – 240 с.].
Расчет теплоты сгорания по методу Коновалова
Метод применим для расчета теплоты сгорания газообразных органических соединений. Расчет ведется по формуле

где m – число атомов кислорода, необходимое для полного сгорания органического вещества;
n – число молей воды, образующейся при сгорания органического вещества;
Δ – тепловая поправка.
Пример 1: рассчитать теплоту сгорания газообразного стирола
1. Запишем уравнение реакции полного сгорания 1 моль газообразного стирола
С8Н8(г)+10О2(г)=8СО2(г)+4Н2О(ж)
Из уравнения следует, что m=10·2=20; n=4.
2. Из справочника находим значения поправок – для стирола это поправки на фенильную группу (24 ккал/моль) и двойную связь (21 ккал/моль).
3. Рассчитаем значение
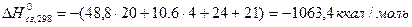
Справочная величина: -1060,9 ккал/моль. [Казанская А.С., Скобло В.Н. Расчёты химических равновесий. М.: Высшая школа,1974.-288с.].
Пример 2: рассчитать теплоту сгорания газообразного хлороформа
1. Запишем уравнение реакции полного сгорания 1 моль газообразного хлороформа
СНСl3(г)+3О2(г)=СО2(г)+НСl(г)+Сl2(г)
Из уравнения следует, что m=3·2=6; n=0.
2. Тепловые поправки на галогены отсутствуют
3. Рассчитаем значение
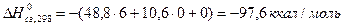
Справочная величина: -96,25 ккал/моль [Казанская А.С., Скобло В.Н. Расчёты химических равновесий. М.: Высшая школа,1974.-288с.].
 2020-04-12
2020-04-12 2056
2056