Р а б о т а 8
Опыт 5. Изучение зависимости эдс гальванического элемента из стеклянного и хлорсеребряного электродов от активности ионов водорода
Цель работы –освоение методики измерения разности потенциалов (электродвижущей силы) гальванического элемента из стеклянного и хлорсеребряного электродов. Изучение зависимости ЭДС данной пары электродов от активности ионов водорода в исследуемом растворе.
Приборы и оборудование:
РН-метр-милливольтметр рН-150М, комбинированный электрод ЭСК-10603, магнитная мешалка ПЭ-6110, перемешивающий стержень, штатив для электродов, бюретки (3 шт.), промывалка, стаканы химические на 50 мл (5 шт.).
Реактивы:
стандартные буферные растворы, имеющие рН 1,68; 3,56; 4,01; растворы соляной кислоты HCl (0,1; 0,01; 0,001 M).
В работе изучается гальванический элемент, состоящий из стеклянного ионоселективного и хлорсеребряного электродов.
Стеклянный электрод является наиболее распространенным ионоселективным электродом. При соприкосновении водного раствора со стеклом, состоящим из силикатов щелочных, щелочноземельных и некоторых других металлов, возможен обмен катионов металла в стекле на ионы водорода из раствора. Благодаря этой реакции на границе контакта «стекло-раствор» возникает скачок потенциала, величина которого зависит от активности Н+ в широком диапазоне изменения рН.
Кроме того, на величину скачка потенциала влияют активности других ионов, принимающих участие в процессе обмена. Так, если мешающими ионами являются ионы Na+, уравнение для скачка потенциала имеет вид
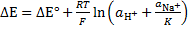 ,
,
где К – константа соответствующей реакции обмена ионов. Для изготовления водород-селективных стеклянных электродов применяют стекла, для которых К>>1. Таким образом, в кислых, нейтральных и слабощелочных средах, когда значение 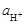 достаточно велико, слагаемым, учитывающим вклад ионов Na+, можно пренебречь, а значит скачок потенциала линейно зависит от логарифма активности Н+, т.е. от рН.
достаточно велико, слагаемым, учитывающим вклад ионов Na+, можно пренебречь, а значит скачок потенциала линейно зависит от логарифма активности Н+, т.е. от рН.
С ростом рН среды влияние ионов Na+ (и других щелочных металлов) усиливается, в результате чего зависимость 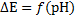 перестает быть линейной. Это отклонение от линейной зависимости в щелочных средах называется щелочной ошибкой стеклянного электрода. Щелочная ошибка растет с ростом температуры. Так, если при температуре до 30 °С она проявляется обычно после рН=9,5, приводя к получению заниженных результатов рН, то при 50 °С отклонения начинаются при рН=8, а при 60 °С – при 5–6. В сильно щелочных средах преобладающим является уже вклад иона щелочного металла, и стеклянный электрод становится не водород-селективным, а металл-селективным электродом. В этой области, использовать стеклянный электрод для определения рН нельзя.
перестает быть линейной. Это отклонение от линейной зависимости в щелочных средах называется щелочной ошибкой стеклянного электрода. Щелочная ошибка растет с ростом температуры. Так, если при температуре до 30 °С она проявляется обычно после рН=9,5, приводя к получению заниженных результатов рН, то при 50 °С отклонения начинаются при рН=8, а при 60 °С – при 5–6. В сильно щелочных средах преобладающим является уже вклад иона щелочного металла, и стеклянный электрод становится не водород-селективным, а металл-селективным электродом. В этой области, использовать стеклянный электрод для определения рН нельзя.
Помимо щелочной ошибки существует и кислотная, противоположная по знаку щелочной. Она в наибольшей степени проявляется в случае кислот с анионами малого размера и, вероятно, связана с адсорбцией анионов. Область, в которой потенциал линейно зависит от рН, называется областью водородной функции стеклянного электрода. В настоящее время разработаны такие стекла, которые позволяют измерять рН стеклянным электродом в области от -2 до +14. Для стеклянных электродов, обычно применяемых в лаборатории, этот диапазон уже и составляет примерно 0–12 (верхний предел указан для растворов с содержанием Na+ не выше 0,1 М).
 | |||
| |||
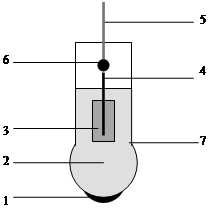
Конструктивно стеклянный электрод представляет собой стеклянную трубку с выдутым на одном конце шариком, который заполнен раствором соляной кислоты с погруженным в нее хлорсеребряным электродом (серебряной проволокой, покрытой слоем труднорастворимой соли AgCl) (рис. 1). Внутренний хлорсеребряный электрод выполняет функцию устройства, осуществляющего смену одних носителей заряда на другие, а именно ионов, обеспечивающих электропроводность стекла, на электроны, играющие ту же роль во внешнем металлическом токоотводе. Смена носителей осуществляется за счет обратимой окислительно-восстановительной реакции
Ag+Cl– 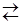 AgCl+ē.
AgCl+ē.
Она отличается высокой скоростью и практически постоянством активностей всех участвующих в процессе веществ. Благодаря этому на границе контакта устанавливается устойчивая и воспроизводимая разность потенциалов.
Хлорсеребряный электрод. В качествеэлектрода сравнения при измерении потенциала исследуемого электрода, разности потенциалов в гальваническом элементе часто используют хлорсеребряный электрод, отличающийся от внутреннего тем, что электролитом для него служит раствор КCl, а не НCl. Достоинствами этого электрода сравнения являются простота эксплуатации и хорошо воспроизводящаяся, стабильная величина электродного потенциала. Последнее обусловлено стабильностью концентрации ионов Ag+ в растворе, заполняющем электрод. Так, в данном случае для системы «раствор - осадок» уравнение закона действующих масс имеет вид
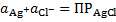 .
.
Отсюда следует, что активность ионов Ag+ будет определяться температурой, влияющей на величину 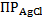 , и активностью ионов Cl–. В случае проведения измерений при комнатной температуре колебания температуры незначительны и слабо влияют на величину ПР. Что же касается концентрации ионов Сl–, то при использовании для заполнения электрода насыщенного раствора KCl, она сохраняет постоянное значение даже при испарении части растворителя, так как избыточное количество KCl в этом случае выпадает в осадок. Дополнительным достоинством насыщенного раствора KCl является низкий диффузионный потенциал на границе контакта «исследуемый раствор – раствор, заполняющий электрод сравнения». Последнее обусловлено близостью подвижностей ионов K+ и Cl– в сочетании с их высокой концентрацией.
, и активностью ионов Cl–. В случае проведения измерений при комнатной температуре колебания температуры незначительны и слабо влияют на величину ПР. Что же касается концентрации ионов Сl–, то при использовании для заполнения электрода насыщенного раствора KCl, она сохраняет постоянное значение даже при испарении части растворителя, так как избыточное количество KCl в этом случае выпадает в осадок. Дополнительным достоинством насыщенного раствора KCl является низкий диффузионный потенциал на границе контакта «исследуемый раствор – раствор, заполняющий электрод сравнения». Последнее обусловлено близостью подвижностей ионов K+ и Cl– в сочетании с их высокой концентрацией.
В настоящей работе используется комбинированный стеклянный электрод (рис. 2), в котором в одном корпусе находится и стеклянный измерительный электрод, потенциал которого зависит от концентрации (активности) ионов водорода и хлорсеребряный электрод сравнения, находящийся в растворе 3М КС1.
|
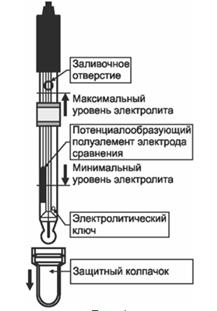
Так как потенциал внутреннего хлорсеребряного электрода в 3 М растворе КС1 является постоянной величиной при постоянной температуре, то ЭДС данного гальванического элемента зависит от потенциала стеклянного электрода и соответственно от активности ионов водорода.
Схема данного гальванического элемента, используемого для измерения зависимости электродвижущей силы от активности ионов водорода в исследуемом растворе может быть представлена следующим образом:
Ag│AgClтв; 3 М КCl│стеклянная мембрана│ Н+ ║3М KCl; AgClтв│Ag
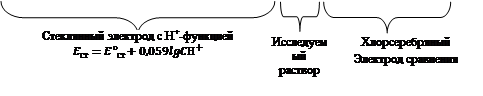
Поскольку сопротивление стеклянной мембраны велико, для измерения ЭДС такого элемента используют высокоомные потенциометры, к которым можно отнести используемый в настоящей работе рН-метр-милливольтметр рН-150М. Прибор рН-метр-милливольтметр рН-150М в комплекте с комбинированным стеклянным электродом позволяет измерять ЭДС с точностью ±0,5 mv.
Выполнение опыта
1. Ознакомьтесь с измерительной установкой, состоящей из рН-метра-милливольтметра и штатива с комбинированным стеклянным электрод, погруженным в стакан с дистиллированной водой.
2. Включите прибор в сеть и прогрейте не менее 10 мин,
3. Убедитесь, что включен режим измерения электродвижущей силы, «mv».
4. Проведите измерение разности потенциалов (электродвижущей силы, Е) гальванического элемента из стеклянного и хлорсеребряного электродов в стандартном растворе кислоты НС1 с концентрацией 10-4 моль/л. Для этого осторожно извлеките электрод из стакана с дистиллированной водой, осушите электрод фильтровальной бумагой. ВНИМАНИЕ! Стеклянный электрод хрупок, поэтому прикасайтесь бумагой к электроду осторожно, стараясь не повредить стеклянную мембрану. Налейте в стакан с надписью «№4» из колбы соответствующий раствор и погрузите в него измерительный комбинированный электрод. Глубина погружения электрода в раствор при измерении ЭДС должна быть не менее 16 мм.
5. Выдержите электрод в исследуемом растворе 3 минуты, запишите показание прибора, если в течении последней минуты значение Е не менялось.
6. Измерьте Е для остальных стандартных растворов с концентрациями 10-3 моль/л, 10-2 моль/л и 10-1 моль/л, значения занесите в таблицу 1.
7. После измерения ЭДС в раствореНС1 с концентрацией 10-1 , электрод поместите в новую порцию дистиллированной воды.
8. Заполните таблицу 1, рассчитав необходимые значения. Коэффициенты активности определите по таблице 3, приведенной в приложении к данному опыту.
9. Постройте градуировочный график Е = f (̶ lg а (H+))
10. Проверьте правильность работы прибора по величине крутизны линейной части характеристики Е = f (̶ lg а (H+)). Величина крутизны исследуемой пары электродов (стеклянного и хлорсеребряного) в зависимости от температуры должна лежать в диапазоне от минус 56 mv до минус 61 mv на единицу ̶ lg а (H+).
11. Получите у преподавателя исследуемый раствор и измерьте для него значение Е.
12. По градуировочному графику определите активность ионов водорода в контрольном растворе. Погрешность экспериментального значения не должна превышать 15% по отношению к контрольному значению активности ионов водорода, полученному у преподавателя.
Оформление опыта
1. Запишите температуру, при которой производились измерения.
2. Запишите схему электрохимической системы комбинированного электрода из стеклянного и хлорсеребряного электродов.
3. Внесите результаты в таблицы 1 и 2.
Таблица 1
Зависимость ЭДС гальванического элемента из стеклянного и хлорсеребряного электродов (комбинированного электрода) от активности ионов водорода
| Концентрация стандартного раствора НС1, С (НС1), моль/л | Ионная сила раствора, I | Коэффициент активности, y (H+) | Активность ионов водорода, а (H+) | ̶ lg а (H+) | Е, mv | Крутизна, Δ Ена единицу lg а (H+) |
Таблица 2
Исследуемый раствор
| Исследуемый раствор: | Е, mv | ̶ lg а (H+) | Экспериментальное значение аэ (H+) (по градуировочному графику) | Контрольное значение ак( H+) | Относительная погрешность, % |
4. Постройте градуировочный график зависимости ЭДС от логарифма активности ионов водорода, Е = f (̶ lg а (H+))
5. Определите концентрацию ионов водорода в исследуемом растворе по градуировочному графику. Результат сравните с истинным значением, полученным у преподавателя, рассчитав относительную погрешность.
Контрольные вопросы
1. Активность, ионная сила, коэффициент активности.
2. Ионное произведение воды, водородный показатель.
4. Уравнение Нернста для потенциала электрода
5. Потенциометрический метод определения концентрации/активности потенциалопределяющих ионов.
ПРИЛОЖЕНИЕ
к опыту 5 лабораторной работы №8
Таблица 3
| № п/п | I | Заряд иона | № п/п | I | Заряд иона | ||||
| ±1 | ±2 | ±3 | ±1 | ±2 | ±3 | ||||
| 1 | 0,002 | 0,97 | 0,74 | 0,66 | 6 | 0,1 | 0,81 | 0,44 | 0,16 |
| 2 | 0,005 | 0,95 | 0,66 | 0,55 | 7 | 0,2 | 0,81 | 0,41 | 0,14 |
| 3 | 0,01 | 0,92 | 0,60 | 0,47 | 8 | 0,3 | 0,81 | 0,42 | 0,14 |
| 4 | 0,02 | 0,90 | 0,53 | 0,37 | 9 | 0,4 | 0,82 | 0,45 | 0,17 |
| 5 | 0,05 | 0,84 | 0,50 | 0,21 | 10 | 0,5 | 0,84 | 0,50 | 0,20 |
Приближенные значения коэффициентов активности (у±) ионов при различных ионных силах раствора (I)
 2020-04-12
2020-04-12 739
739






