СЛ. 13 Под эквивалентной электропроводностью понимают электропроводность столба раствора, содержащего 1 г-экв растворенного вещества, заключенного между электродами, находящимися друг от друга на расстоянии в 1 см. Обозначается эквивалентная электропроводность буквой l (греч. «ламбда»), причем индексом внизу показывают обычно объем (в литрах), в котором содержится 1 г-экв электролита. Например, l10 – эквивалентная электропроводность 0,1 н. раствора электролита, т. е. раствора, содержащего 1 г-экв растворенного вещества.
Физический смысл эквивалентной электропроводности состоит в следующем (рис. 3 СЛ. 14).
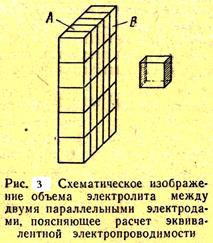
Предположим, что какой-то объем раствора электролита, содержащий 1 г-экв растворенного вещества, находится в сосуде с плоскопараллельными стенками А и В, которые представляют собой платиновые электроды и находятся на расстоянии 1 см друг от друга. Если объем данного раствора составляет 1 см3, то его электропроводность удельная. Если же объем раствора больше, например, 1 см3, то разобьем мысленно этот объем на n-е число кубиков (на рис. 3 этот кубик показан справа), каждый из которых будет иметь
удельную электропроводность c.
Тогда суммарная или в данном случае СЛ. 15 (0) эквивалентная электропроводность всего раствора будет равна: l=nc.
Поскольку в каждом кубике содержится 1/ n грамм-эквивалентов растворенного вещества, концентрация раствора С: в этом кубике также будет равна 1/ п. (1) Отсюда эквивалентная электропроводность будет:
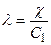
(2) Учитывая, что С1 = С/1000, где С — число грамм-эквивалентов в 1 л раствора, после подстановки этого выражения в последнее уравнение получим:
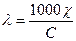
(3) Поскольку концентрация С — величина обратная разбавлению V, последнее уравнение может быть представлено так:
l=1000cV
где V — разбавление раствора (т. е. объем в литрах, содержащий 1 г-экв электролита).
Таким образом, эквивалентная электропроводность раствора электролита равна его удельной электропроводности, умноженной на разбавление, выраженное в см3 на 1 г-экв электролита. Отсюда размерность эквивалентной электропроводности выразится в [см2 – Ом-1 • г-экв-1. Последний множитель определяется уже самим названием эквивалентной электропроводности. Его иногда опускают, и в качестве единицы измерения эквивалентной электропроводности указывают [см2 • олг1], подразумевая на 1 г-экв.
СЛ. 16 Эквивалентная электропроводность у сильных и слабых электролитов возрастает с увеличением разбавления (т. е. с уменьшением концентрации раствора) и достигает некоторого предельного значения, которое называется электропроводностью при бесконечном разбавлении. Обозначается она буквой l¥ или l 0. Это явление объясняется тем, что по мере разбавления растворов слабых электролитов растет степень электролитической диссоциации a, для сильных же электролитов увеличивается расстояние между ионами, в результате чего силы взаимного притяжения ослабевают и скорость движения ионов повышается.
Если выразить зависимость l от 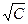 графически, то для слабых электролитов в области больших разбавлений получается кривая, а для сильных — прямая линия (рис. 4
графически, то для слабых электролитов в области больших разбавлений получается кривая, а для сильных — прямая линия (рис. 4 СЛ. 17).
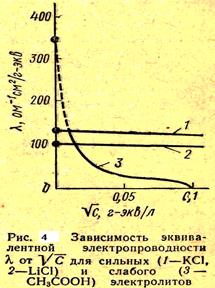
СЛ. 18 (0) Для разбавленных растворов (не выше 0,002 н.) сильных электролитов зависимость l от 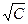
(1) довольно хорошо выражается эмпирическим уравнением:
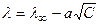
(2) где а — угловой коэффициент, зависящий от природы растворителя, температуры и валентности электролита. Второй член этого уравнения а 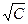 характеризует уменьшение электропроводности вследствие взаимного торможения ионов, природа которого обусловлена наличием ионных атмосфер, окружающих все находящиеся в растворе ионы.
характеризует уменьшение электропроводности вследствие взаимного торможения ионов, природа которого обусловлена наличием ионных атмосфер, окружающих все находящиеся в растворе ионы.
Эквивалентная электропроводность зависит от температуры. Для большинства электролитов электропроводность увеличивается с повышением температуры, что объясняется увеличением скорости движения ионов в растворе. (3) Это увеличение имеет линейный характер:
lt = l18[1+ n(t-18)]
где lt и l18 — эквивалентная электропроводность при температуре 18°С, n — температурный коэффициент электропроводности. Увеличение температуры на один градус приводит к возрастанию эквивалентной электропроводности в среднем на 2—2,5%. Вот почему при всех измерениях электропроводности необходимо тщательное термостатирование.
Для некоторых электролитов электропроводность с увеличением температуры уменьшается, что характерно для неводных растворов и обусловлено уменьшением диэлектрической проницаемости растворителя.
 2015-05-26
2015-05-26 3605
3605








