Конденсация альдегидов и кетонов с фенолами идет с удалением карбонильного атома =О (в виде воды), а метиленовая группа СН2- или замещенная метиленовая группа (-СНR либо -СR2) встраивается между двумя молекулами фенола. Наиболее широко эту реакцию применяют для получения фенолоформальдегидных смол. Фенол конденсируется с ацетоном в кислой среде с образованием так называемого бисфенола А.

Реакция Кольбе
Оригинальный метод введения карбоксильной группы в ароматическое кольцо был открыт Г.Кольбе в 1860 году. При нагревании сухих фенолятов натрия или лития с СО2 при 150-180оС и давлении 5 атм, образуются натриевые или литиевые соли салициловой кислоты. В аналогичных условиях из фенолятов калия, рубидия и цезия получаются только соли пара-гидроксибензойной кислоты.


Такое различие в направлении карбоксилирования Na- и К-солей фенола принято объяснять различием в хелатообразовании этих двух катионов с атомом кислорода CO2 в переходном состоянии реакции приводящем к салициловой кислоте. Катионы натрия и, особенно, лития значительно более эффективны по сравнению с катионом калия в способности к образованию координационной связи с атомом кислорода.

Предполагается, что для фенолятов калия, рубидия и цезия электрофильная атака осуществляется исключительно в пара-положение без какой-либо координации катиона по атому кислорода.
Более подробное изучение указывает на то, что механизм этой внешне очень простой реакции намного более сложен, чем это принято считать.
Безводные моносалицилаты калия и рубидия при нагревании до 200-220оС дают ди-К- и ди-Rb-соли пара-гидроксибензойной кислоты и фенол.

Натриевая соль пара-гидроксибензойной кислоты при нагревании превращается в динатриевую соль салициловой кислоты:

Из этого следует, что карбоксилирование щелочных фенолятов представляет собой обратимую реакцию и направление ее зависит только от природы катиона. В отличие от одноатомных фенолов двухатомные и трехатомные фенолы карбоксилируются в более мягких условиях.
Азосочетание
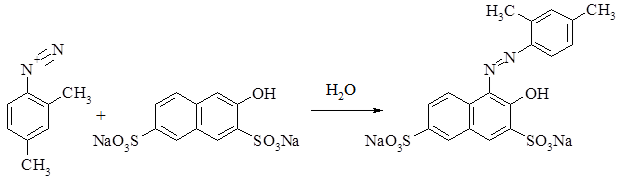
Фенолы при взаимодействии с солями арендиазония в слабощелочной среде образуют арилазофенолы. Эта реакция получила название азосочетания. По своему механизму реакция азосочетания является реакцией электрофильного замещения, в которой соли арендиазония выступают в качестве электрофильных реагентов.
Перегруппировка Кляйзена
В 1912 году Л.Кляйзен открыл интересную и своеобразную перегруппировку аллиловых эфиров фенолов в аллилфенолы. Аллиловый эфир фенола при нагревании до 200-220оС превращается в орто-аллилфенол, т.е. аллильная группа мигрирует в орто-положение бензольного кольца.

Если оба орто-положения заняты заместителями, то аллильная группа перемещается в пара-положение:

Установлено, что и орто- и пара-перегруппировки являются внутримолекулярными реакциями первого порядка, которые сопровождаются инверсией мигрирующей аллильной группы, т.е. аллильная группа присоединяется к бензольному кольцу своим  -углеродным атомом.
-углеродным атомом.

Из этого следует, что переходное состояние перегруппировки Кляйзена должно быть циклическим шестизвенным. Такое переходное состояние включает шесть  -электронов и является ароматическим, что составляет движущую силу этой термической перегруппировки. На последней стадии происходит изомеризация циклогексадиенона в о-аллилфенол. Эта стадия полностью аналогична изомеризации кетона в енольную форму.
-электронов и является ароматическим, что составляет движущую силу этой термической перегруппировки. На последней стадии происходит изомеризация циклогексадиенона в о-аллилфенол. Эта стадия полностью аналогична изомеризации кетона в енольную форму.

Окисление фенолов
Окисление пространственно незатрудненных фенолов относится к числу сложных, многостадийных процессов, механизм которых мало изучен. Очевидно лишь то, что механизм окисления может сильно меняться в зависимости от природы одно- или двухэлектронного окислителя. Сам фенол при окислении двухэлектронным окислителем - бихроматом натрия или MnO2 в серной кислоте образует с удовлетворительным выходом пара-хинон.

Универсальным одноэлектронным окислителем фенолов является соль Фреми - нитрозодисульфонат калия - редкий пример стабильного неорганического нитроксильного свободного радикала, полученного впервые еще в 1845 году. Окисление фенолов солью Фреми идет в очень мягких условиях по радикальному механизму и приводит к пара-хинонам с выходами, близкими к количественному.

Самый простой и удобный способ получения орто- и пара-бензохинонов состоит в окислении соответственно пирокатехина и гидрохинона.


Практическая часть
1. 2,2’-дигидроски-1,1’-бинафтил (β-бинафтол)
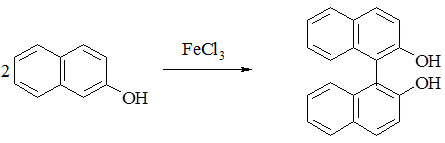
Исходные вещества: β-нафтол - 3 г
FeCl3·6H2O - 5,68 г
К кипящему раствору 1,5 г β-нафтола в 200 мл дистиллированной воды при перемешивании медленно приливают раствор 2,84 г гексагидрата хлорида железа FeCl3·6H2O в 20 мл воды. При этом образуется белый осадок бинафтола. Затем в этом же растворе растворяют ещё 1,5 г β-нафтола, а затем снова при кипении прикапывают раствор 2,84 г FeCl3·6H2O в 20 мл воды.
Реакционную смесь перемешивают еще 30 минут при температуре 100°C. Осадок бинафтола отфильтровывают и кипятят его в 200 мл воды для удаления избытка β-нафтола. После фильтрования продукт перекристаллизовывают из EtOH-H2O. Получают 2,65 г (88 %) продукта в виде бесцветных игл с Тпл=215°С.
Pасчет синтеза
| Реактив и формула | Характеристики исходных веществ | Количества исходных вещест | ||||||||
| Молекулярная масса | Физиологическое действие | const | Для кислот и щелочей | По методике | По ур-нию реакции в молях | Избыток в молях | ||||
| Tпл, °С | % | D204 | мл | г | моль | |||||
β-нафтол  144обладает сильными антисептическими и паразитотропными свойствами1221,2172,530,022- 144обладает сильными антисептическими и паразитотропными свойствами1221,2172,530,022- | ||||||||||
| Гексагидрат хлорида железа FeCl3·6H2O | 270,5 | является токсичным | 307,5 | 2,9 | 5,68 | 0,02 | 2 | - | ||
Характеристика основного продукта
| Название | Молекулярная масса | Физиологическое действие | Константы | Растворимость | Кислотно-основные свойства | Отделение продукта | |||
| Tпл, °С | Tкип, °С | D204 | N20d | ||||||
| Бинафтол | 286 | 215°С | |||||||
Константы и выход вещества
| Название и формула | Константы | Выход | |||||
| Молекулярная масса | Tпл, °С | Tкип, °С | г | От теоретического, % | От указанного в методике, % | Теоретический, г | |
Бинафтол  286202°С2,587952,86 286202°С2,587952,86 | |||||||
Механизм

О- и п-нитрофенолы

В трехгорлую колбу емкостью 50 мл помещают 18,5 мл 20% азотной кислоты и при охлаждении колбы холодной водой и механическом перемешивании по каплям вводят раствор 2,82 фенола в 3-4 мл воды. Реакционная масса при этом становится темно-коричневой. После введения всего фенола смесь перемешивают еще в течении 1-2 часов. Затем водный раствор кислоты сливают, темное тяжелое масло несколько раз промывают водой и, перенося в круглодонную колбу, подвергают перегонке с водяным паром. Отгоняющийся при этом о-нитрофенол затвердевает в форштоссе холодильника, откуда его целесообразно время от времени извлекать, не изменяя режима перегонки, при помощи проволоки, загнутой на конце. По окончании отгонки о-нитрофенол отфильтровывают на воронке Бюхнера и высушивают. Выход около 1 г (23 % от теоретического). Тпл=45°С.
Для выделения п-нитрофенола в перегонную колбу добавляют 17 мл 10% NaOH, переносят полученный раствор в фарфоровую чашку и упаривают на водяной бане до тех пор, пока капля раствора не будет выкристаллизовываться. Раствор охлаждают, выделившийся п-нитрофенол отфильтровывают на воронке Бюхнера, тщательно отжимают на фильтре при помощи стеклянной пробки и два раза промывают небольшим количеством 40% раствора NaOH. Посветлевшую массу растворяют при нагревании в 8-10 мл 10% раствора соляной кислоты. Раствор кипятят с активированным углем до обесцвечивания. Из отфильтрованного от угля раствора при охлаждении выпадает п-нитрофенол, в виде бесцветных игл. Выход около 0,25 г. Тпл=114°С
Расчет синтеза
| Реактив и формула | Характеристики исходных веществ | Количества исходных вещест | ||||||||
| Молекулярная масса | Физиологическое действие | const | Для кислот и щелочей | По методике | По ур-нию реакции в молях | Избыток в молях | ||||
| Tпл, °С | % | D204 | мл | г | моль | |||||
Фенол  94Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу.40,81,072,62,820,02981- 94Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу.40,81,072,62,820,02981- | ||||||||||
| Азотная кислота HNO3 | 63 | токсична | -41,59 | 20 | 1,115 | 18,5 | 21 | 0,3 | 1 | 0,2702 |
| Гидроксид натрия NaOH | 40 | токсичен | 323 | 10 | 1,1089 | 17 | 19 | 0,475 | 1 | 0,4452 |
| Соляная кислота HCl | 36,5 | токсична | -18 | 10 | 1,0476 | 9 | 9,4 | 0,26 | 1 | 0,2302 |
Характеристика основного продукта
| Название | Молекулярная масса | Физиологическое действие | Константы | Растворимость | Кислотно-основные свойства | Отделение продукта | |||
| Tпл, °С | Tкип, °С | D204 | N20d | ||||||
| О-нитрофенол | 139 | Поражают центральную нервную систему, печень | 45 | 214 | 1,29 | ||||
| П-нитрофенол | 114 | 279 | 1,479 | ||||||
Константы и выход вещества
| Название и формула | Константы | Выход | |||||
| Молекулярная масса | Tпл, °С | Tкип, °С | г | От теоретического, % | От указанного в методике, % | Теоретический, г | |
| О-нитрофенол | 139 | 45 | 214 | 0,9 | 22 | 90 | 4,1 |
| П-нитрофенол | 114 | 279 | 0,2 | 5 | 80 | 4,1 | |
Механизм
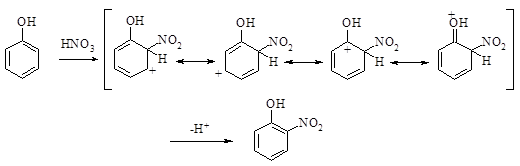
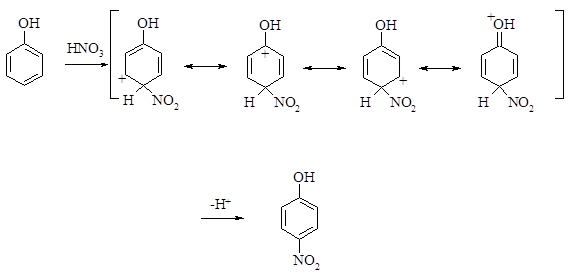
Заключение
В работе были рассмотрены основные способы получения фенолов и их химические свойства, приведены примеры важнейших реакций. Так же были синтезированы три соединения со следующими выходами (от теоретического):
бинафтол (87 %);
о-нитрофенол (22 %);
п-нитрофенол (5 %).
Роль фенолов в жизни человека очень велика. В настоящее время наибольшее количество фенола используется для получения фенолформальдегидных смол, которые применяются в производстве фенопластов. Двухатомные фенолы и их производные входят в состав дубителей для кожи <http://www.xumuk.ru/encyklopedia/2047.html> и меха, модификаторов и стабилизаторов <http://www.xumuk.ru/encyklopedia/2/4182.html> резин <http://www.xumuk.ru/encyklopedia/2/3860.html> и каучуков <http://www.xumuk.ru/bse/1243.html>, применяются для обработки кино- и фотоматериалов <http://www.xumuk.ru/encyklopedia/2/4879.html>. В медицине фенолы и их производные используют в качестве антимикробных (фенол, резорцин <http://www.xumuk.ru/encyklopedia/2/3866.html>), противовоспалительных (салол, осарсол <http://www.xumuk.ru/farmacevt/1495.html>), спазмолитических (адреналин <http://www.xumuk.ru/encyklopedia/38.html>, папаверин <http://www.xumuk.ru/encyklopedia/2/3185.html>), жаропонижающих (аспирин <http://www.xumuk.ru/encyklopedia/431.html>, салициловая к-та), адренолитических (мезатон <http://www.xumuk.ru/lekenc/5670.html>), вяжущих (таннины <http://www.xumuk.ru/encyklopedia/2/4311.html>) и других лекарственных средств, а также витаминов <http://www.xumuk.ru/encyklopedia/776.html> E и P.
Список используемой литературы
1. Физер Л., Физер М. Органическая химия. Углубленный курс. В 2-х т. - М.: Химия, 1966.
2. Гауптман З., Грефе Ю., Ремане Х. Органическая химия. Пер. с нем. Терентьевой П.Б., Чурановой С.С./Под ред. В.М. Потапова - М.: Химия, 1979.
. Реутов О.А., Курц А.Л., Бутин К.П. Органическая химия. - М.: Бином, 1999.
. Грандберг И.И. Органическая химия. - М.: Дрофа, 2001.
. Храмкина М.Н. Практикум по органической синтезу. - Л.: Химия, 1997.
. Агрономов А.Е. Избранные главы органической химии. - М.: Химия, 1990.
. Шабаров Ю.С. Органическая химия в 2-х т. - М.: Химия, 1994.
. Кери Ф., Стандберг Р. Углубленный курс органической химии. Реакции и синтезы. - М.: Химия, 1981.
. Агрономов А.Е., Шабаров Ю.С. Лабораторные работы в органическом практикуме. - М.: Химия, 1974.
. Гиттис С.С., Глаз А.И., Иванов А.В. Практикум по органической химии. - М.: Высшая школа, 1991.
 2020-04-20
2020-04-20 1015
1015







