Будь-яке тіло або система тіл має механічну енергію / кінетичну та потенціальну/, так і внутрішню, яка складається з кінетичної енергії теплового поступального та обертального руху молекул, коливань атомів в молекулах, потенціальної енергії міжмолекулярної взаємодії, енергії електронів в атомі та енергії нуклонів в ядрі. Внутрішня енергія одноатомного ідеального газу повністю визначається його абсолютною температурою і дорівнює
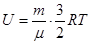 .
.
У відсутності взаємодії між системою і зовнішнім середовищем внутрішня енергія системи не змінюється.
Внутрішня енергія системи змінюється при взаємодії системи з зовнішніми тілами. При цьому обмін енергіями відбувається або при виконанні роботи, або шляхом теплообміну.
Кількість енергії, що передають системі зовнішні тіла при взаємодії, називається роботою. Якщо система нерухома, то виконання роботи відбувається при зміні об’єму системи зовнішніми силами:
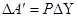
По закону збереження енергії робота 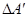 , що виконують зовнішні сили над системою, чисельно дорівнює роботі DA, що виконує система проти зовнішніх сил:
, що виконують зовнішні сили над системою, чисельно дорівнює роботі DA, що виконує система проти зовнішніх сил:
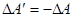
Кількість енергії, що передають системі зовнішні тіла шляхом теплообміну, називають кількістю теплоти, наданої системі
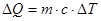

де с – питома теплоємність, це – фізична величина, яка дорівнює кількості теплоти, що необхідно надати одиниці маси речовини, щоб змінити її температуру на I K.
Крім цього, використовують молярну теплоємність 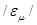 , яка зв’язана з питомою співвідношенням:
, яка зв’язана з питомою співвідношенням:
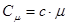 ,
,
де m – молярна маса речовини.
Тоді:
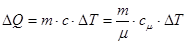
В механіці виконується закон збереження механічної енергії. А оскільки тепловий рух – це також механічний рух окремих молекул, то при всіх змінах енергії повинен виконуватись закон збереження енергії з урахуванням не тільки зовнішнього, а й внутрішнього рухів. Тому. Зміна внутрішньої енергії повинна дорівнювати сумі роботи 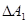 , що виконують зовнішні сили над системою та кількості теплоти, що надасться системі.
, що виконують зовнішні сили над системою та кількості теплоти, що надасться системі.
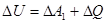 .
.
Частіше розглядають не роботу зовнішніх сил над системою, а роботу системи проти зовнішніх сил / 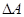 /, а оскільки
/, а оскільки
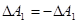
 , то
, то 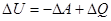 , або
, або 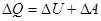 /1/ _
/1/ _
це – математичний запис закону збереження енергії в теплових процесах, або перший закон термодинаміки: теплота, що надасться системі, витрачається на зміну внутрішньої енергії системи та на виконання системою роботи проти зовнішніх сил.
З першого закону термодинаміки виходить, що якщо DQ = 0, то DA = -DU. Таким чином, якщо система не одержує енергії, то вона виконує роботу тільки за рахунок зменшення внутрішньої енергії, яка кінцева. Кінцевою буде і робота. Отже: вічний двигун першого роду неможливий – це також формуліровка першого закону термодинаміки.
Розглянемо використання 1-го закону термодинаміки до ізопроцесів в ідеальному газі. Оскільки
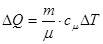 , а
, а 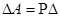 V,
V,
то 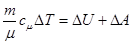 .
.
1. Ізохоричний процес / V=const / здійснюється при нагріванні газу в замкненому об’ємі. Оскільки DV = 0, то А=0, і тоді I закон термодинаміки запишеться так:
DQ =DU – вся теплота, що надасться системі, використовується на зміну внутрішньої енергії:
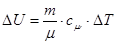 , /2/
, /2/
де 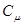 – молярна теплоємність при сталому об’ємі / V=const /.
– молярна теплоємність при сталому об’ємі / V=const /.
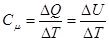 .
.
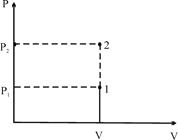
2. Ізобаричний процес / р =const /.
В цьому випадку 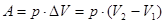 /площа прямокутника/ і тоді I закон термодинаміки:
/площа прямокутника/ і тоді I закон термодинаміки:
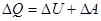 .
.
Теплота, що надасться системі, витрачається на зміну внутрішньої енергії і на виконання роботи проти зовнішніх сил.
Молярна теплоємність в ізобаричному процесі 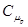 дорівнює
дорівнює
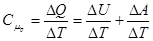 ,
,
але 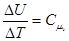 і тоді
і тоді 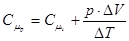 . Для одного моля pV = RT
. Для одного моля pV = RT
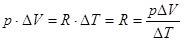 .
.
Таким чином, 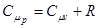 - рівняння Майєра:
- рівняння Майєра:
Молярна теплоємність при сталому тиску більша молярної теплоємності при сталому об’ємі на величину універсальної газової сталої.
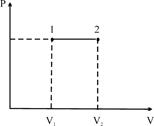
3. Ізотермічний процес / Т = const /. Оскільки DE = 0, то DU = 0 – внутрішня енергія газу не змінюється, і тоді 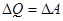 - теплота, що надасться системі в ізотермічному процесі витрачається на роботу розширення газу. Розрахунки показують, що
- теплота, що надасться системі в ізотермічному процесі витрачається на роботу розширення газу. Розрахунки показують, що
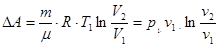 .
.
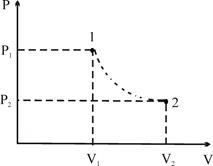
4. Адіабатичний процес – це процес без теплообміну системи з зовнішнім середовищем: DQ = 0. Тоді з I закону термодинаміки слідує:
DA = -DU, тобто в адіабатичному процесі робота виконується за рахунок внутрішньої енергії газу. Для ідеального газу:
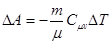 .
.
В адіабатичному процесі розширення газу (DA = PDn>0) супроводжується його охолодженням (DT< 0), а при стисканні DA< 0, а DT> 0 – газ нагрівається.
Процес можна вважати адіабатичним, якщо він протікає так швидко, що за час його здійснення не відбувається теплообмін з навколишнім середовищем / в двигунах внутрішнього згорання при стисканні температура зростає до 500–600о С, а рідке паливо запалюється та інше /.
В адіабатичному процесі стан ідеального газу описується рівнянням Пуассона:
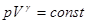 ,
,
де 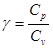 .
.
 2020-04-20
2020-04-20 144
144








