Характерною властивістю металів є їхня здатність лише віддавати електрони й утворювати вільні позитивно заряджені йони. Для металів не характерне утворення сполук, в яких вони мають негативний ступінь окиснення. Метали здатні заміщувати Гідроген у кислотах і утворювати солі. Отже, метали можуть бути тільки відновниками.
Найактивніші метали мають малі значення потенціалів йонізації. Атоми активних металів мають великі радіуси і незначну кількість електронів на зовнішньому енергетичному рівні. За величиною потенціала йонізації можна порівняти активність металів у розрідженому газовому середовищі. На повітрі, й особливо у воді, активність металів об'єктивніше характеризується стандартним електродним потенціалом, який визначає, наскільки легко утворюються позитивно заряджені йони з нейтральних атомів за наявності води. Стандартний потенціал — це напруга, що виникає між металом і розчином його солі за активності йонів цього металу, що дорівнює одиниці. Величини стандартних потенціалів відносні. Здатність металів легко утворювати вільні позитивно заряджені йони виявляється в реакціях взаємного витіснення металів або під час взаємодії деяких із них з кислотами-неокисниками [17].
Ряд електрохімічних потенціалів ґрунтується на кількісних значеннях стандартних потенціалів. Всі активні метали, які здатні витісняти Гідроген з кислот-неокисників, стоять у ряду електрохімічних потенціалів до водню. Благородні метали мають позитивні значення стандартних потенціалів і розміщуються за воднем. Зіставивши величини стандартних потенціалів, можна зробити висновок, який з металів витіснятиме інший метал із розчину його солі.
Положення металу в ряду електрохімічних потенціалів характеризує його здатність до окисно-відновних перетворень за стандартних умов. Чим ближче метал розміщений до початку ряду електрохімічних потенціалів, тим сильніші відновні властивості його атомів і тим слабкіші окиснювальні властивості його йонів у водному розчині.
Природні сполуки металів. Добування металів
Більшість металів у земній корі перебуває у вигляді сполук з іншими елементами. У самородному стані трапляються тільки благородні метали, які характеризуються високими потенціалами йонізації (золото, платина, платинові метали, частково срібло, мідь і ртуть).
Мінерали або їх суміші, придатні для промислового добування металів, називаються рудами. Рудами є суміші благородного металу або його сполуки з різними силікатами. Пустою породою називаються домішки, що супроводжують метал або його сполуку в руді.
Найчастіше в земній корі трапляються малорозчинні у воді та стійкі проти окиснення мінерали.
Досить стійкими і малорозчинними є сульфіди багатьох металів. Іноді сульфіди трапляються разом з арсенідами (руди Co та Ni). Сульфідні руди, що містять цинк, свинець, срібло, мідь, бісмут з домішками рідкісних металів (германій, реній, індій), називаються поліметалічнимирудами.
Сульфідів активних металів у земній корі не виявлено, оскільки вони нестійкі [12].
Лужноземельні метали і рідкісноземельні елементи в природі трапляються у вигляді не розчинних у воді карбонатів, фторидів, фосфатів. Кальцій, стронцій і барій входять до складу сульфатних мінералів, лужні метали — до складу подвійних силікатів. Для натрію і калію поширеними є хлоридні мінерали, які утворилися в результаті кристалізації розчинів під час висихання озер і морів.
Добуванням металів з руд займається галузь промисловості — металургія.
Для збагачення руд застосовують методи магнітної та гравітаційної сепарації, пінної флотації. Магнітну сепарацію можна застосовувати лише тоді, коли потрібний компонент руди виявляє магнітні властивості, і руди, притягуючись до магніта, переносяться ним у збірник руди. Методом гравітаційної сепарації здійснюється відокремлення мінералу, який потрібно вилучити з руди, від домішок за допомогою важких розчинів, що мають проміжну густину (між густиною мінералу і домішок). Часточки легкого компонента спливають на поверхню.
Флотація ґрунтується на різній змочуваності водою пустої породи і мінералу. Часточки компонента, який змочується водою, поглинаються, а часточки, що не змочуються, спливають на поверхню.
Для добування металу з його сполуки, що міститься у руді, потрібно його відновити.
Найважливішим методом добування металів із руд є відновлення їхніх оксидів вуглецем або оксидом карбону (ІІ).
Відновлення металів із руд вуглецем і оксидом карбону (II) відбувається за високих температур, тому цей метод добування металів належить до пірометалургійних.
Для металів, які не відновлюються вуглецем і оксидом карбону(ІІ) (активні метали), застосовують сильніші відновники: водень, магній, алюміній, силіцій. Метод відновлення оксиду одного металу іншим металом називається металотермією (якщо відновником є алюміній — алюмотермією). Метало-термічним методом виплавляють титан, цирконій, рідкісноземельні метали, уран, хром тощо.
Для добування металів застосовують також гідрометалургійний метод, тобто електроліз водних розчинів солей та витіснення металів з їхніх розчинів іншими металами. Гідрометалургійним методом добувають золото (витіснення його з ціанідних розчинів за допомогою цинку) [17].
Електропірометалургійним методом добувають лужні, лужноземельні метали, алюміній, титан, торій, ніобій, тантал. Суть цього методу полягає в електролізі розплавлених солей. За цим методом добувають дуже активні метали, які не можна добути, використовуючи звичайні відновники.
Сплави
У рідкому стані більшість металів розчиняється один в одному, утворюючи рідкий сплав. Сплавами називаються гомогенні суміші металів у розплавленому і затверділому станах. Затверділі сплави мають різну природу: вони можуть виявляти характер твердих розчинів, хімічних сполук, бути гетерогенними.
Щоб визначити природу сплаву, поверхню досліджують мікроскопічним методом, а також піддають його рентгеноструктурному аналізу. Проте найчастіше сплави досліджують, проводячи фізико-хімічний аналіз [17].
Про взаємодію між металами можна судити на підставі вимірювання питомої електропровідності систем (електропровідність окремих металів вища за електропровідність утворених ними інтерметалідів). Внаслідок взаємодії металів змінюється їхня твердість, магнітна сприйнятливість. Склад утвореного металіду можна визначити, не виділяючи його в чистому вигляді, якщо вивчати зміну однієї з названих властивостей.
Нині фізико-хімічний аналіз є основним методом вивчення природи різних сплавів. Розділ фізико-хімічного аналізу, що досліджує перетворення в системі за зміною температури її плавлення або тверднення залежно від складу, називається термічним аналізом. Діаграми температура плавлення — склад називаються діаграмами стану, або діаграмами плавлення системи. Термічний аналіз до вивчення сплавів вперше застосував у 1868 р. Д. К. Чернов, а в 1900 р. видатний російський вчений М. С. Курнаков розробив метод встановлення складу сполук у сплавах за допомогою термічного аналізу.
Для того щоб побудувати діаграму стану, досліджують експериментально криві охолодження. Розплавлений чистий метал поступово охолоджують, вимірюючи зміну температури сплаву з часом. На діаграмі температура — час дістають горизонтальну лінію, що відповідає температурі плавлення металу (затримка в охолодженні металу зумовлена виділенням прихованої теплоти кристалізації). Якщо до металу А додати метал В, то в разі поступового охолодження рідкого сплаву кристали металу А осідатимуть за нижчої температури, ніж коли б це був чистий метал. Якщо ж до чистого металу В додати метал А, спостерігатиметься аналогічна картина. Щоб побудувати діаграму стану для двохкомпонентної системи, виготовляють суміші двох чистих металів із різним їх кількісним складом, розплавляють їх і визначають температури початку кристалізації як зупинки на діаграмах температура — час (рис. 2).
Діаграми плавлення мають різну форму залежно від характеру взаємодії компонентів суміші між собою.
Якщо два метали між собою не утворюють сполуку, а в твердому стані не утворюють розчин, то діаграма стану для такої системи має так звану евтектичну точку, яка вказує на існування сплаву з найнижчою температурою плавлення. Сплав, який має таку низьку температуру плавлення, у твердому стані є сумішшю дрібних кристалів і називається евтектикою.
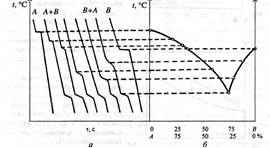
Рис. 2. Криві охолодження (а) та діаграма стану двохкомпонентної системи (б)
Термічний аналіз дає змогу виявити велику кількість сполук одних металів з іншими (інтерметалідних сполук). Такі сполуки утворюють лужні, лужноземельні метали з металами, що мають слабкі металічні властивості. Склад інтерметалідних сполук виражається формулами, в яких валентності металів не збігаються з валентностями цих металів у сполуках з неметалами. Наприклад, натрій з оловом утворює такі сполуки: NaSn4, NaSn6, NaSn3, NaSn2, NaSn, Na4Sn2, Na2Sn, Na4Sn.
Властивості сплавів відрізняються від властивостей компонентів сплаву. Температура плавлення сплаву, як правило, нижча за температуру плавлення найбільш легкоплавкого його компонента, а твердість вища, ніж твердість складових частин сплаву. Особливо сильно зростає твердість сплаву, якщо під час сплавляння утворюються хімічні сполуки металів. Високою твердістю характеризуються сплави, що містять тверді розчини. Низькі температури плавлення, висока твердість надають сплавам більшої цінності для сучасної техніки, ніж цінність металів, з яких їх виготовляють [17].
РОЗДІЛ 2. ФОРМИ ОРГАНІЗАЦІЇ НАВЧАННЯ ПРИ ВИВЧЕННІ ТЕМИ „МЕТАЛИ” В ШКІЛЬНОМУ КУРСІ ХІМІЇ
 2020-04-20
2020-04-20 160
160








