РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПРИ ПОДГОТОВКЕ К КОНТРОЛЬНОЙ РАБОТЕ №1
Задача №2-1 (Кривая титрования слабой кислоты сильным основанием)
К 15,00 мл раствора уксусной кислоты с концентрацией 0,0970 моль/л добавили раствор гидроксида натрия с концентрацией 0,1005 моль/л и объемом 12,30 мл. Константа кислотности уксусной кислоты Ka(CH3COOH)=1,76·10-5.
- Напишите уравнение титриметрической реакции в молекулярном и сокращенном ионном виде.
- Укажите формулы эквивалентных частиц анализируемого вещества и титранта.
- Рассчитайте степень оттитрованности τ анализируемого компонента.
- Укажите состав раствора при установлении в титриметрической системе равновесия.
- Выведите формулу и рассчитайте [ H3O+] и pH раствора при полученном τ.
- Изобразите схематично графики зависимости:
pH =f(τ), рОН=f(τ), [H3O+]=f(τ), [OH-]=f(τ)
Решение
1. Из условия задачи следует, что анализируемый компонент – это уксусная кислота (CH3COOH), поскольку к ней добавляют другой раствор, а титрант – это гидроксид натрия (NaOH), поскольку его добавляют. Таким образом, то, к чему добавляют – это X, то, что добавляют – это T:
X= CH3COOH
T= NaOH
Это необходимо отметить для себя, чтобы избежать ошибки в дальнейшем при расчете степени оттитрованности.
2. Необходимо записать уравнение титриметрической реакции в молекулярном виде с необходимыми стехиометрическими коэффициентами и в сокращенной ионной форме c учетом того, что уксусная кислота является слабой кислотой и ее диссоциацией можно пренебречь, как и в случае с водой:
CH3COOH+ NaOH=CH3COONa + H2O
CH3COOH + OH- = CH3COO- + H2O,
где:
CH3COOH= Х – анализируемый компонент,
NaOH= Т – титрант,
CH3COONa= Р – продукт титриметрической реакции, распадающийся на ионы,
CH3COO- и Na+, поскольку является растворимой солью,
H2O= S – растворитель.
Данная титриметрическая реакция относится к типу:
Х+Т = Р + S
3. Необходимо записать формулы эквивалентных частиц анализируемого вещества и титранта.
Для этого вспомним определение эквивалентной частицы, участвующей в кислотно-основной реакции:
«Эквивалентом» является частица или часть частицы, которая взаимодействует с 1H3O+ в кислотно-основной реакции. Для кислоты – это частица или часть частицы, которая будет отдавать 1H3O+, для основания – это частица или часть частицы, которая будет принимать 1H3O+.
Таким образом:
Э(CH3COOH)=CH3COOH
Э(NaOH)= NaOH
4. Необходимо записать общую формулу для расчета степени оттитрованности:
по определению «степень оттитрованности» показывает отношение количества вещества (моль-эквивалентного) добавленного титранта в определенный момент времени к количеству титранта, который надо добавить к анализируемому компоненту, чтобы реализовать момент эквивалентности:
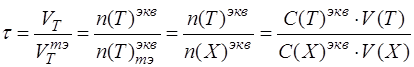
Подставить в формулу конкретные формулы эквивалентных частиц титранта и анализируемого вещества:
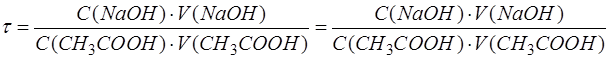
Затем подставить в формулу числа, соответствующие параметрам. Рассчитать, записать результат с запасом цифр и округлить степень оттитрованности до сотых, используя правила округления числа:
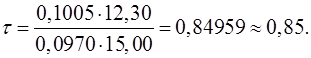
5. Необходимо указать состав раствора при рассчитанном значении степени оттитрованности:
τ=0,85< 1(ТЭ), следовательно, это область недотитрованного раствора уксусной кислоты.
Состав раствора в области недотитрованного анализируемого компонента Х состоит из продуктов соответствующей протекающей реакции или протекающих реакций на этот момент и недотитрованного компонента Х.
Таким образом, в нашем случае состав раствора при τ=0,85< 1 состоит из:
CH3COOH(Xнедотитр), CH3COO-(P), Na+, H2О (S).
Следует отметить, что равновесие в титриметрической системе устанавливается не только в точке эквивалентности, то есть устанавливается всегда независимо от того, добавили или сколько добавили титранта к анализируемому компоненту.
6. Для расчета равновесной концентрации протонов водорода в титриметрической системе при рассчитанном значении степени оттитрованности необходимо сначала найти в составе раствора рН -определяющую частицу.
рН -определяющей частицей является частица, которая при взаимодействии с водой может подавлять равновесие автопротолиза растворителя и давать кислую или щелочную среду. Это кислоты, основания, гидролизующиеся анионы или катионы, амфолитные ионы. Если таких частиц нет, то рН- определяющей частицей будет растворитель - H2О, рН которого рассчитывается из соответствующей константы автопротолиза и равен 7.
В нашем случае:
CH3COOH– слабая кислота,
Na+– негидролизующийся катион,
CH3COO-– гидролизующийся анион, поскольку представляет собой анион от слабой кислоты,
H2О – растворитель.
Таким образом, в составе раствора присутствуют две частицы, способные повлиять на рН воды – это слабая кислота (Х) и ее соль (Р), между которыми в воде устанавливается равновесие:
Х + H2О↔ Р + H3O+
CH3COOH + H2О ↔ CH3COO- + H3O+
Растворы, состоящие из слабой кислоты и сопряженного с ним слабого основания, а также – из слабого основания и сопряженной с ним слабой кислоты, называются буферными растворами.
В буферной системе, строго говоря, существуют два равновесия (на примере кислого буферного раствора HAn+ An-):
(1) HAn + H2О ↔ An- + H3O+
(2) An- + H2О ↔ HAn + OH-
где:
HAn– слабая кислота,
An-– анион слабой кислоты.
Поскольку слабые кислоты и слабые основания имеют степень диссоциации α в растворе менее 5%, то понятно, что соответствующие продукты по реакции протолиза (1) и гидролиза (2) будут образовываться в очень малых количествах. Так для раствора, содержащего только слабую кислоту с концентрацией 0,1 моль/л HАn (Ka (HAn)=1,01·10-5, α =1%), содержание [An-], которое образуется по равновесию (1), можно рассчитать по формуле:
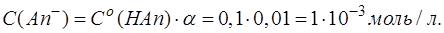
Для раствора, содержащего только соль слабой кислоты с концентрацией 0,1 моль/л Аn- (Kb (An-)=10-14/1,01·10-5=10-9, α =0,003%), содержание кислоты [HAn], которая образуется по равновесию (2), можно рассчитать по аналогичной формуле:
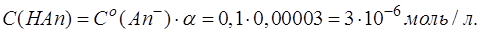
Рассчитанные значения характеризуют растворы, содержащие только один компонент.
В случае буферной системы в растворе одновременно присутствуют оба сопряженных через воду компонента: слабая кислота и ее соль. Это приводит к тому, что наличие слабой кислоты, например, с концентрацией 0,1 моль/л по принципу Ле Шателье подавляет образование такой же частицы по равновесию (2), поскольку ее в растворе больше в (3·104) раз, то есть равновесие гидролиза аниона слабой кислоты сдвинуто влево. В свою очередь, соль слабой кислоты с содержанием 0,1 моль/л в буферной смеси будет смещать равновесие (1) влево, то есть подавлять образование частиц кислоты, поскольку по (1) аниона образуется в 100 раз меньше, чем содержание самой соли в буфере. Таким образом, в буферной системе слабая кислота и сопряженное слабое основание подавляют диссоциацию друг друга и в системе устанавливается равновесие между слабой кислотой, количество которой 0,1 моль/л, и солью слабой кислоты, содержание которой также согласно нашему примеру тоже 0,1 моль/л. Поэтому для буферной смеси записывают одно равновесие:
HAn + H2О ↔ An- + H3O+
Таким образом, в области буферных растворов рН -определяющими частицами являются две частицы, характеризующие буфер, это слабая кислота CH3COOH и соль слабой кислоты CH3COONa в количествах, соответствующих степени оттитрованности анализируемого компонента.
При выводе формулы для расчета рН в области буферного раствора необходимо записать соответствующее равновесие:
CH3COOH + H2О ↔ CH3COO- + H3O+
Затем расписать концентрационную константу этого равновесия:
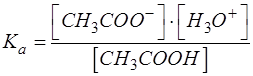
Поскольку в области буферных растворов:
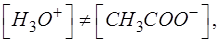
то с учетом этого получаем выражение для равновесной концентрации протонов водорода [H3O+]:
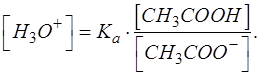
Для дальнейшего решения необходимо выразить равновесные концентрации оставшейся недотитрованной уксусной кислоты и образовавшегося по титриметрической реакции продукта – ацетата натрия с учетом их долей в растворе.
Оставшееся количество CH3COOH (Х) находят по разнице между начальным содержанием CH3COOH (Х) и содержанием образовавшегося из нее продукта. А продукта в свою очередь образуется столько, сколько было добавлено к Х титранта (моль-эквивалентов, поскольку вещества реагируют друг с другом и образуются в результате химической реакции в эквивалентных количествах):
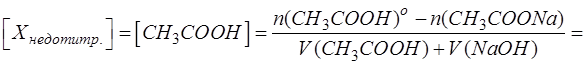
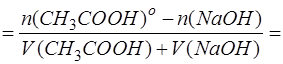
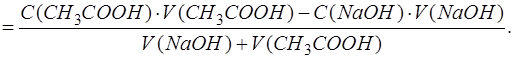
Эквивалентное количество добавленного титранта связано с эквивалентным количеством анализируемого компонента через степень оттитрованности. Из формулы для расчета τ следует:
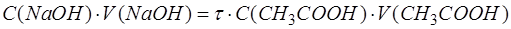
После подстановки последнего выражения в формулу для расчета [CH3COOH] получим следующее выражение:
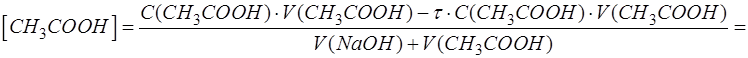
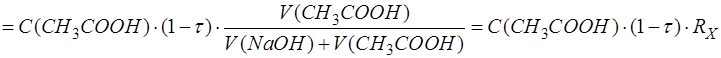
Образовавшееся количество продукта CH3COONa (P) находят по количеству добавленного к анализируемому компоненту титранта с учетом стехиометрии реакции:
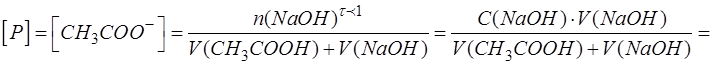
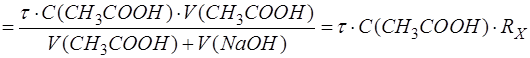
где Rx - разбавление анализируемого компонента Х.
Подставляем [CH3COOH] и [CH3COO-] в выражение для [H3O+]:
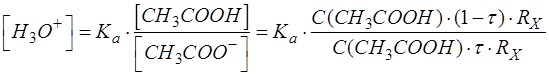
После упрощения выражение имеет вид:
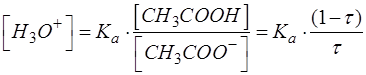
Подставляем соответствующие числовые значения в формулу, рассчитываем, записываем результат с запасом цифр и округляем значение [H3O+] до целого числа.
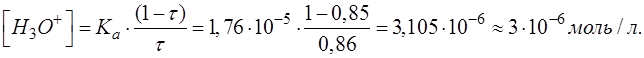
При выводе формул для расчета pH от степени оттитрованности необходимо использовать известное выражение:
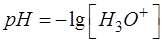
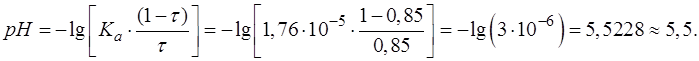
Рассчитанное значение рН округляем до десятых.
7. Необходимо схематично изобразите графики следующих зависимостей:
pH =f(τ), pOH=f(τ), [H3O+]=f(τ), [OH-]=f(τ).
При построении зависимостей необходимо руководствоваться следующим:
- в полулогарифмических координатах (pH=f(τ) или pOH=f(τ)) вид зависимости будет S-образной кривой; S-образная кривая может быть с одной или несколькими ступенями. Это зависит от природы и состава исходного раствора. S-образная кривая может идти из области щелочных растворов в область кислых и наоборот. Это определяется кислотно-основными свойствами исходного анализируемого раствора, поскольку именно анализируемый компонент находится при титровании сначала в избытке и поэтому изначально определяет рН раствора.
- в линейных координатах ([H3O+]=f(τ), [OH-]=f(τ)) вид зависимости – это плавная возрастающая или убывающая кривая. Это определяется кислотно-основными свойствами исходного анализируемого раствора, поскольку именно анализируемый компонент находится при титровании сначала в избытке и поэтому изначально определяет значение [H3O+] и [OH-] раствора.
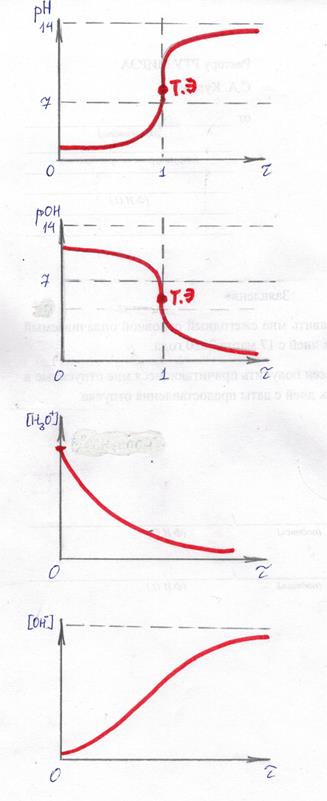
Рисунок 1. Графики зависимости pH =f(τ), pOH=f(τ), [H3O+]=f(τ), [OH-]=f(τ)
при титровании слабой кислоты сильным основанием.
Задача №2-2 (Кривая титрования слабой кислоты сильным основанием)
К 15,00 мл раствора уксусной кислоты с концентрацией 0,0970 моль/л добавили раствор гидроксида натрия с концентрацией 0,1005 моль/л и объемом 14,48 мл. Константа кислотности уксусной кислоты Ka(CH3COOH)=1,76·10-5.
- Напишите уравнение титриметрической реакции в молекулярном и сокращенном ионном виде.
- Укажите формулы эквивалентных частиц анализируемого вещества и титранта.
- Рассчитайте степень оттитрованности τ анализируемого компонента.
- Укажите состав раствора при установлении в титриметрической системе равновесия.
- Выведите формулу и рассчитайте [ H3O+] и pH раствора при полученном τ.
- Изобразите схематично графики зависимости:
pH =f(τ), рОН=f(τ), [H3O+]=f(τ), [OH-]=f(τ)
Решение
С пункта 1 по пункт 3 включительно – из задачи 2-1.
4. Необходимо записать общую формулу для расчета степени оттитрованности:
по определению «степень оттитрованности» показывает отношение количества вещества (моль-эквивалентного) добавленного титранта в определенный момент времени к количеству титранта, который надо добавить к анализируемому компоненту, чтобы реализовать момент эквивалентности:
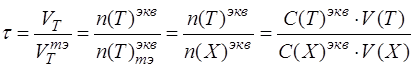
Подставить в формулу конкретные формулы эквивалентных частиц титранта и анализируемого вещества:
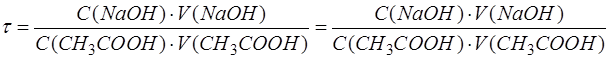
Затем подставить в формулу числа, соответствующие параметрам. Рассчитать, записать результат с запасом цифр и округлить степень оттитрованности до сотых, используя правила округления числа:
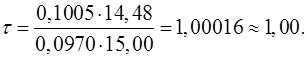
5. Необходимо указать состав раствора при рассчитанном значении степени оттитрованности:
τ=1,00, следовательно, это точка эквивалентности (ТЭ).
Состав раствора в ТЭ состоит из продуктов титриметрической реакции или реакций, которые при достижении титриметрической системой этого момента завершились.
Таким образом, в нашем случае состав раствора при τ=1,00 состоит из:
CH3COO-, Na+, H2О.
Следует отметить, что равновесие в титриметрической системе устанавливается не только в точке эквивалентности, то есть устанавливается всегда независимо от того, добавили или сколько добавили титранта к анализируемому компоненту.
6. Для расчета равновесной концентрации протонов водорода в титриметрической системе при рассчитанном значении степени оттитрованности необходимо сначала найти в составе раствора рН -определяющую частицу.
рН -определяющей частицей является частица, которая при взаимодействии с водой может подавлять равновесие автопротолиза растворителя и давать кислую или щелочную среду. Это кислоты, основания, гидролизующиеся анионы или катионы, амфолитные ионы. Если таких частиц нет, то рН- определяющей частицей будет растворитель - H2О, рН которого рассчитывается из соответствующей константы автопротолиза и равен 7.
В нашем случае:
Na+– негидролизующийся катион,
CH3COO-– гидролизующийся анион,
H2О–растворитель.
рН -определяющей частицей является анион слабой кислоты.
Необходимо записать соответствующее равновесие с рН-определяющей частицей:
CH3COO- + H2О ↔ CH3COOH + OH-
Затем записать концентрационную константу данного равновесия. Поскольку в результате гидролиза образуются гидроксид-ионы, то данной константой будет константа основности ацетат-иона, которая связана с константой кислотности уксусной кислоты:
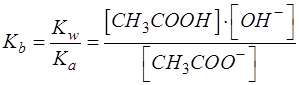
Поскольку в ТЭ нет частиц ОН- и CH3COOH, то выполняется равенство:
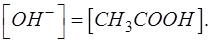
С учетом этого получаем выражение:
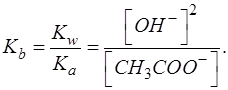
Далее необходимо выразить [OH-]:
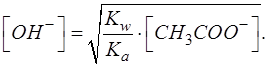
Для вывода расчетной формулы для равновесной концентрации протонов водорода [H3O+] необходимо воспользоваться выражением, связывающим равновесные концентрации протонов водорода и гидроксид-ионов:
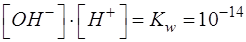
Ацетат натрия является продуктом титриметрической реакции и в ТЭ его образуется столько, сколько первоначально было анализируемого компонента Х – уксусной кислоты с учетом разбавления:
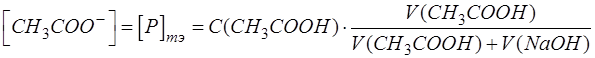
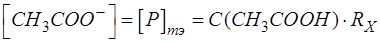
Таким образом приходим к расчетной формуле для [H3O+]:
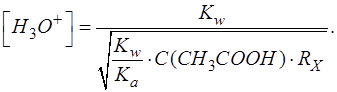
Подставляем соответствующие числовые значения в формулу, рассчитываем, записываем результат с запасом цифр и округляем значение [H3O+] до целого числа:
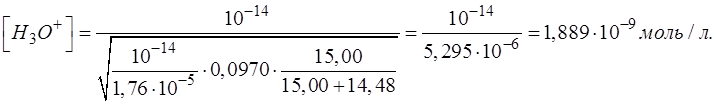
Результат после округления:
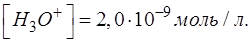
При выводе формул для расчета pH от степени оттитрованности необходимо использовать известное выражение:
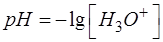
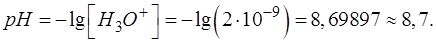
Пункт 7 аналогичен пункту 7 задачи 2-1.
 2020-05-11
2020-05-11 358
358







