Алексеева Е.И., Серокурова Ю.Л., Михайлова С.Б.
Химия
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
Курган - 2020
СОДЕРЖАНИЕ
| 1 теОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ........................................................ | |
| Основные понятия и законы химии. Классы неорганических соединений………………………………………………………………... | |
| Основы химической кинетики. Равновесие.................................................. | |
| Растворы........................................................................................................... | |
| Окислительно-восстановительные реакции (ОВР)……………………….. Химия элементов……………......................................................................... | |
| 2 Лабораторный практикум.................................................................. | |
| Задания для выполнения лабораторных работ............................................. | |
| СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ................................................. |
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
Теоретические основы химии необходимо законспектировать в лекционную тетрадь.
Основные понятия и законы химии. Классы неорганических соединений
Основные понятия и законы химии
В химии наиболее важное практическое значение имеют понятия, представленные на рисунке 1. Схема демонстрирует взаимосвязь основных понятий химии (отмечены курсивом), которые дополняются ключевыми признаками (отмечены мелким шрифтом над стрелками) для правильной формулировки определения.
Рисунок 1 – Взаимосвязь основных понятий химии
Пример. Расшифровать фрагменты схемы: 1) «вещества → условная запись → химический символ → химическая формула»; 2) «элемент → условная запись → химический символ»; 3) «химическая формула → индекс». Написать формулу сульфата калия, указать химические символы и индексы.
Решение. Определения записываются в обратном порядке:
Химическая формула – условная запись состава вещества с помощью химических символов.
Химический символ – условная запись химического элемента.
Индекс – число атомов элемента в химической формуле.
| Химическая формула: | K2SO4 |
| Химические символы: | K, S, O |
| Индексы: | 2, 1 (не пишется в формуле), 4 |
Химическая формула, отражающая состав вещества, может быть или молекулярной (для газов, жидкостей и некоторых твердых веществ), или эмпирической (для веществ немолекулярного строения). В случае, если отражен порядок соединения атомов в веществе, то химическая формула будет называться структурной или графической (подробнее в теме 1.3, понятие «валентность»).
Для понимания основ химии и решения задач различной сложности также необходимо знать определения некоторых физических величин и формулировки основных законов химии.
Относительная атомная масса (Аr) - масса атома, выраженная в углеродных единицах (а.е.м.), или физическая величина, показывающая, во сколько раз масса атома данного элемента тяжелее 1/12 части массы изотопа углерода-12 (12 С). Относительную атомную массуэлемента Аr(Э) находят в периодической системе, округляя имеющееся значение до целого числа по правилам математики (исключение Аr(Сl) = 35,5).
Относительная молекулярная масса (Mr) – физическая величина, определяемая отношением массы молекулы данного вещества к 1/12 части массы 12 С. Относительную молекулярную массу какого-либо вещества Mr(ЭxByOz) можно рассчитать по формуле:
Mr(ЭxByOz) = Аr(Э)∙х + Аr(В)∙y + Аr(О)∙z,
где х, y, z – индексы при элементах Э, В, О соответственно.
Массовая доля элемента - физическая величина, равная отношению массы элемента к массе вещества и выражаемая в долях или процентах:
где ω(Э) – массовая доля элемента в веществе (%), m(Э) и m(ЭxByOz) - массы элемента и вещества соответственно, выраженные в единицах массы.
Объёмная доля – физическая величина, равная отношению объёма какого-либо компонента смеси к объёму всей смеси газов или жидкостей, выражаемая в долях или процентах:
где φ – объемная доля компонента в смеси, V – объем компонента, Vобщ – объем смеси.
Количество вещества (n) – физическая величина, определяемая числом структурных единиц (частиц) этого вещества, выраженного в моль.
Моль - это количество вещества, содержащее 6,02·1023 атомов или молекул этого вещества. Число 6,02·1023 называется постоянной Авогадро и является важнейшей константой (NA = 6,02·1023 моль-1).
где N – общее число частиц.
Количественно масса 1 моль вещества численно равна его атомной или молекулярной массе. Таким образом, любое химическое соединение характеризуется молярной массой М, выражаемой, как правило, в г/моль. Связь между количеством и массой вещества выражается формулой:

Применяя количественные методы при исследовании химических процессов, М.В. Ломоносов в 1756 г. установил, что при химических превращениях общая масса веществ остается неизменной. Это открытие стало законом сохранения массы: масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции.
Другим по значимости после закона сохранения массы веществ является закон постоянства состава химических соединений, который формулируется следующим образом: каждое индивидуальное химическое соединение независимо от способа его получения состоит из одних и тех же элементов, соотношения, между массами которых постоянны. Однако позже выяснилось, что наряду с соединениями постоянного состава (дальтониды), существуют соединения переменного состава (бертоллиды). Например, оксид ванадия (II) может иметь в зависимости от условий получения состав от V0,9О до V1,3О, оксид марганца (II) имеет переменный состав MnO1,6, а реальный состав оксида железа (II) находится в пределах от Fe0,89О до Fe0,95O.
Реальные газы в определенных границах температур и давлений подобны идеальному газу и подчиняются закону Авогадро: при одинаковых условиях в равных объемах любых газов содержится одинаковое число частиц. Большое значение имеют, как сам закон Авогадро, так и следствия из него.
Первым следствием из закона Авогадро является утверждение: при одинаковых условиях равные количества моль различных газов занимают равные объемы. При нормальных условиях (н.у.) – Т =273 К и р =1,013∙105 Па – 1 моль любого газа занимает объем 22,4 л. Этот объем называется молярным объемом газа при н.у и обозначается Vm.
Из второго следствия из закона Авогадро следует, что отношение масс равных объемов различных газов, измеренных при одинаковых условиях, называется плотностью одного газа относительно другого D:
М1 = DМ2
Согласно молекулярно-кинетической теории, уравнение состояния идеального газа имеет вид:
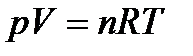 ,
,
где р – давление газа (Па); V – объем газа (м3); n – количество вещества (моль); R – универсальная газовая постоянная; Т – абсолютная температура (К).
Это уравнение получило название уравнения Клайперона-Менделеева.
Взаимосвязь между тремя параметрами р, V, Т, характеризующими со-стояние газа данной массы, выражается объединенным газовым законом:
 ,
,
где Р0, V0, Т0 – давление, объем газа и температура при нормальных условиях.
При н.у. для одного моль газа величина  и является одинаковой для всех газов. Она называется универсальной газовой постоянной и имеет значение 8,314
и является одинаковой для всех газов. Она называется универсальной газовой постоянной и имеет значение 8,314  .
.
На практике часто приходится встречаться со смесью различных газов (например, воздух). В этом случае необходимо применять вышерассмотренные газовые законы для каждого газа в отдельности и затем суммировать полученные величины. При этом пользуются законом парциальных давлений: общее давление газовой смеси равно сумме парциальных давлений отдельных газов, составляющих данную смесь

Из формулировки закона следует, что парциальное давление представляет собой частичное давление, создаваемое отдельным газом. Парциальное давление - это такое давление, которое бы создавал данный газ, если бы он один занимал весь объем, занимаемый смесью.
Закон эквивалентов: элементы соединяются друг с другом и замещают один другого в количествах, пропорционально их эквивалентам.
 ,
,
где m1 и m2 – массы реагирующих и образующихся веществ; Э1 и Э2 – эквиваленты этих веществ.
Эквивалент вещества - это такое количество химического вещества, которое реагирует с 1 г водорода или вытесняет такое же количество водорода из его соединений. Величина Э определяется экспериментально, по уравнению реакции или, чаще всего, исходя из химической формулы вещества и его принадлежности к тому или иному классу химических соединений.
 ,
,
где В - валентность химического элемента, образующего оксид; А - число атомов химического элемента (катиона).
 ,
,


Закон сохранения массы, закон постоянства состава, закон кратных отношений, закон объемных отношений, закон Авогадро относят к основным законам стехиометрии - разделу химии, посвященному изучению количественных соотношений, в которых вещества вступают в химическое взаимодействие друг с другом, а также правилам вывода химических формул и написания уравнений химических реакций.
Расчеты по формулам и уравнениям проводят, используя, в основном, физическую величину «количество вещества».
При выводе химической формулы АxByOz, соотношение индексов х:y:z можно выразить через количество, массы или массовые доли элементов в этом соединении:
Стехиометрией реакции называют соотношение между количествами вступающих в реакцию реагентов и образующихся продуктов.
Для реакции, представленной в виде стехиометрического уравнения
,
где A, B – исходные вещества или реагенты, C, D – продукты реакции, a, b, c, d – стехиометрические коэффициенты в уравнении, соотношение количества вещества реагентов и продуктов можно представить как
.
Зная, что
,
можно найти необходимую физическую величину для конкретного реагента или продукта реакции.
Если даны массы нескольких реагентов, то расчет масс остальных веществ ведут по недостатку, то есть веществу с наименьшим значением n.
Стехиометрия широко используются в биохимических, клинических, санитарно-гигиенических и фармацевтических лабораториях для расчетов результатов анализов, при приготовлении растворов заданных концентраций, для вычисления выходов продуктов реакций.
 2020-05-12
2020-05-12 117
117







