Химической кинетикой называется учение о скоростях химических реакций. От скорости химических реакций в различных технологических процессах зависят производительность и габариты заводской аппаратуры, течение тех или иных биологических процессов, эффективность действия на растения и живой организм различных химических препаратов.
При изучении скорости химических реакций необходимо различать реакции в гомогенных и гетерогенных системах. Первые называются гомогенными реакциями, вторые – гетерогенными. Гомогенные и гетерогенные реакции существенным образом отличаются друг от друга как по механизму химического взаимодействия, так и по многим закономерностям кинетики.
Реагентами называют начальные молекулы, вступающие в реакцию, а продуктами - молекулы, образующиеся в результате протекания реакций.
Скорость химической реакции – это изменение молярной концентрации одного из веществ в единицу времени:
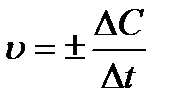
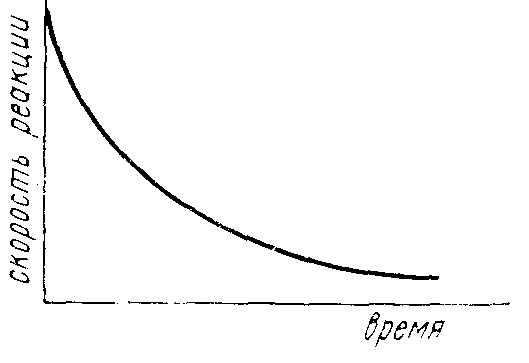
Графическая зависимость концентрации вещества от времени протекания реакции и скорости реакции от времени представлена на рисунке 3.
Необходимым условием химического взаимодействия различных веществ является столкновение их молекул. Тогда, очевидно, что скорость химического взаимодействия должна определяться числом столкновений молекул в единицу времени. Вероятность столкновения молекул различных веществ друг с другом пропорциональна концентрациям реагирующих веществ.

а б
Рисунок 3 – Кинетические кривые (а) и зависимость скорости реакции от времени (б)
Гульдбергом и Вааге в 1867 году экспериментально было показано, что в простейших случаях скорость гомогенных реакций пропорциональна произведению концентрации реагирующих веществ. Данная зависимость была названа закон действия масс, которыйформулируется так: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам.
υ = k[A]a·[B]b
Например, для реакции водорода с азотом:
3Н2 + N2 ↔ 2NH3,
υ 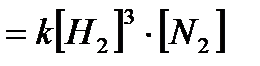 .
.
Опыт показывает, что с повышением температуры скорость реакции, как правило, возрастает. Количественно эта зависимость выражается правилом Вант-Гоффа. Согласно этому правилу, при повышении температуры реакционной смеси на каждые 10 градусов скорость гомогенных химических реакций увеличивается в два-четыре раза.
Математически правило Вант-Гоффа может быть записано следующим образом:
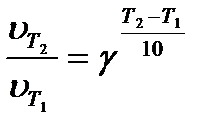
где γ – температурный коэффициент скорости реакции; 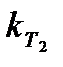 и
и  - константы скорости при разных температурах.
- константы скорости при разных температурах.
Более точная зависимость константы скорости химической реакции от температуры была найдена Аррениусом (1889 г.). Уравнение Аррениуса имеет вид:

где k – константа скорости реакции; А – постоянная интегрирования; Е – энергия активации; R – газовая постоянная; Т – температура.
Многие химические реакции протекают так, что взятые вещества целиком превращаются в конечные продукты, т.е. процесс идет до конца. Такие реакции называются необратимыми. Примером такой реакции может служить взаимодействие цинка с соляной кислотой: Zn + 2HCl = ZnCl2 + H2↑.
Однако при очень многих химических превращениях процессы могут протекать как в прямом, так и в обратном направлениях одновременно. Такие реакции называют обратимыми. Примером обратимой реакции является взаимодействие оксида серы (IV) с кислородом: 2SO2 + O2 ↔ 2SO3.
Для обратимых реакций применимо понятие химического равновесия. Химическое равновесие характеризуется тем, что скорость прямой реакции становится равной скорости обратной реакции, и концентрации всех участвующих в реакции веществ остаются постоянными (равновесными). Количественная характеристика химического равновесия может быть выражена через константу химического равновесия, которая в общем виде для обратимой химической реакции типа аA + bB ↔ cC + dD записывается так:
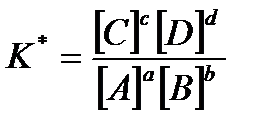
При постоянных внешних условиях – концентрация, давление, температура – химическое равновесие сохраняется как угодно долго. Изменение хотя бы одного из указанных факторов ведет к нарушению равновесия, смещая его в ту или иную сторону. Влияние различных факторов на смещение химического равновесия определяется принципом Ле-Шателье (1884 г.): при изменении в равновесной системе одного из параметров состояния (р, Т, С) происходит смещение равновесия в направлении процесса, ведущего к ослаблению произведенного воздействия.
Факторы, влияющие на смещение химического равновесия
1 Температура. Увеличение температуры смещает положение химического равновесия в сторону эндотермической реакции, понижение температуры смещает равновесие в сторону экзотермической реакции:
2 Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул), при уменьшении давления равновесие смещается в сторону увеличению объема. Если реакция протекает без изменения числа молекул газообразных веществ, то давление не влияет на положение равновесия в системе.
3 Концентрация. При увеличении концентрации одного из реагирующих веществ равновесие смещается в сторону расхода этого вещества, при уменьшении концентрации равновесие смещается в сторону образования этого вещества.
Растворы
При смешении веществ в твердом, жидком или газообразном состоянии могут происходить либо химические реакции, либо образование смеси веществ, либо оба процесса. Смеси веществ по степени дисперсности (дисперсность - характеристика размеров частиц данного вещества) можно классифицировать следующим образом: грубодисперсные - размер частиц диспергированного вещества составляет 1000 нм и более; коллоидные растворы - размер частиц диспергированного вещества 1-100 нм; истинные растворы - размер частиц диспергированного вещества определяется размером ионов, молекул, ионных пар и различных ассоциатов.
Истинные растворы - гомогенные системы переменного состава, содержащие частицы (атомы, молекулы или ионы) растворенного вещества, частицы растворителя и продукты взаимодействия частиц растворенного вещества с частицами растворителя.
Вещество, присутствующее в растворе в большем количестве, обычно называют растворителем, а другие вещества - растворенными веществами. Если одно из веществ раствора является жидкостью, а другие - твердыми или газообразными веществами, то растворителем принято называть жидкость даже тогда, когда остальные вещества присутствуют в растворе в большем количестве. Растворителем также считают то вещество, агрегатное состояние которого не изменяется при образовании раствора. Однако данные определения произвольны и носят условный характер.
В зависимости от агрегатного состояния растворителя различают газообразные (воздух и другие смеси газов), жидкие (гомогенные смеси газов, жидкостей и твердых тел с жидкостями) и твердые (сплавы, стекло) растворы. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Наиболее распространенным растворителем из неорганических веществ является вода. Из органических веществ в качестве растворителей используют метанол, этанол, диэтиловый эфир, ацетон, бензол и др.
Состояние раствора определяется тремя основными параметрами: температурой, давлением и концентрацией растворенных веществ. При растворении данного вещества в данном растворителе при постоянных давлении и температуре концентрация растворенного вещества увеличивается не беспредельно. В определенный момент времени вещество перестает растворяться, достигается определенная его концентрация, которая при дальнейшем, даже самом длительном контакте растворяемого вещества и растворителя в условиях интенсивного перемешивания, уже более не изменяется и остается величиной постоянной. Это признак наступления фазового равновесия: растворяемое вещество↔ раствор. Фазовое равновесие «растворяемое вещество↔раствор» по своему характеру является равновесием динамическим: непрерывно какая-то часть вещества переходит в раствор, растворяется, и одновременно такая же часть этого вещества выделяется из раствора: 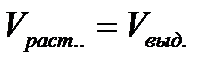 При этом агрегатное состояние вещества, растворяемого и выделяющегося, является одним и тем же.
При этом агрегатное состояние вещества, растворяемого и выделяющегося, является одним и тем же.
В зависимости от содержания в растворе растворенного вещества растворы делятся на насыщенные, перенасыщенные и ненасыщенные.
Насыщенный раствор - раствор, находящийся в фазовом равновесии с растворяемым веществом.
Пересыщенный раствор – неустойчивый раствор, в котором содержание растворенного вещества больше, чем в насыщенном растворе этого же вещества, при тех же значениях температуры и давления. Появление в таких растворах кристалла растворенного вещества вызывает одновременное появление в объеме раствора многих кристаллов вещества – массовую кристаллизацию.
Ненасыщенный раствор - раствор, в котором при данных температуре и давлении возможно дальнейшее растворение уже содержащегося в нем вещества. Такие растворы всегда представляют собой однофазную систему.
Количественно состав растворов выражают концентрацией. Концентрация вещества в растворе – величина, измеряемая количеством или массой растворенного вещества в определенном объеме или массе раствора (иногда растворителя). Наиболее употребительны следующие способы выражения концентрации: массовая доля, молярная концентрация, молярная концентрация эквивалента, моляльная концентрация, мольная доля, титр.
Массовая доля (ω) – это отношение массы растворенного вещества к общей массе раствора:
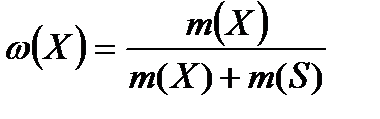
где т(Х) – масса растворенного вещества; т(S) – масса растворителя. Массовую долю выражают в долях единицы или в процентах (например, ω = 0,01 или ω = 1%).
Молярная концентрация (СМ) показывает число молей растворенного вещества, содержащееся в 1 л раствора (моль/л):

где п(Х) – количество растворенного вещества; М(Х) – молярная масса растворенного вещества; V – объем раствора.
Молярная концентрация эквивалента (нормальная концентрация) (СН) показывает число моль эквивалентов растворенного вещества, содержащееся в 1 л раствора (моль-экв/л):

где Э(Х) – эквивалент растворенного вещества.
Моляльная концентрация (Сm) показывает число моль растворенного вещества, содержащееся в 1 кг растворителя (моль/кг):
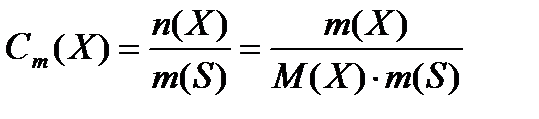
Мольная доля (N) растворенного вещества – безразмерная величина, равная отношению количества растворенного вещества к общему количеству веществ в растворе:
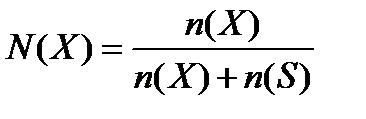
где n(S) – количество вещества растворителя.
Титр (Т) раствора – число граммов растворенного вещества, содержащееся в 1 мл раствора (г/мл):
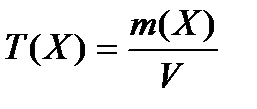
По способности вещества распадаться или не распадаться в расплаве или растворе на ионы различают, соответственно, электролиты и неэлектролиты. Неэлектролиты - это вещества, которые не распадаются на ионы и вследствие чего их растворы и расплавы не проводят электрический ток. К неэлектролитам относят большую часть органических соединений, например, бензол, глюкозу, крахмал (важнейшие исключения: органические кислоты и органические основания). Электролиты - это вещества, расплавы или растворы, которые проводят электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить растворы кислот, солей и оснований.
В 1887 г. шведский ученый Серванте Аррениус предложил теорию электролитической диссоциации.
1 При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы, т.е. подвергаются электролитической диссоциации.
2 Под действием электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3 Электролитическая диссоциация - процесс обратимый (обратная реакция называется моляризацией).
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником:
CaCl2 → Ca2+ + 2Cl-
KAl(SO4)2 → K+ + Al3+ + 2SO42-
HNO3 →H+ + NO3-
Ba(OH)2 →Ba2+ + 2OH-
Одним из важных понятий теории электролитической диссоциации является понятие о степени диссоциации растворенного вещества. Степенью диссоциации называется отношение числа молекул (n), распавшихся на ионы, к общему числу молекул (N), введенных в раствор:

Очевидно, что степень диссоциации α может изменяться от нуля (диссоциации нет) до 1 (полная диссоциация). Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора. Для уксусной кислоты CH3COOH величина α равна 4% (в 0,01М растворе). Это значит, что в водном растворе кислоты лишь 4 из каждых 100 молекул диссоциированы, т.е. находятся в виде ионов Н+ и СН3СОО -, остальные же 96 молекул недиссоциированы.
Константа диссоциации - вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например, когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы. Константа диссоциации обычно обозначается K и обратна константе ассоциации. В случае с солями, константу диссоциации иногда называют константой ионизации.
В общей реакции АхВу ↔ хА + уВ, где комплекс AxBy разбивается на x единиц A и y единиц B, константа диссоциации определяется так:
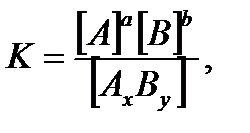
где [A], [B] и [AxBy] - концентрации A, B и комплекса AxBy соответственно.
Связь между К, α и концентрацией раствора выражается законом разбавления Оствальда:
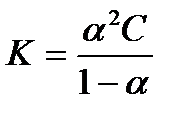
если α мала, то α в знаменателе по сравнению с единицей можно пренебречь и тогда Кд = α2С. Отсюда:
α = 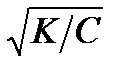
Теория электролитической диссоциации Аррениуса дала возможность объяснить многие особенности химических свойств электролитов (реакция гидролиза, буферные растворы, значение концентрации ионов водорода и др.). Однако она имела и ряд недостатков, главный из которых - это игнорирование взаимодействия частиц растворенного вещества между собой, а также с молекулами растворителя.
В 1923 г. Дебай и Гюккель создали теорию сильных электролитов, согласно которой в растворах сильных электролитов действуют силы притяжения между разноименными ионами и силы отталкивания между одноименными. Учет этого взаимодействия вложен в понятие активности «а». С понятием «активности» связано и другое понятие – коэффициент активности «ƒ», который характеризует степень отклонения свойств реальных растворов от свойств идеальных растворов. Численно коэффициент активности равен:

Для очень разбавленных растворов, где незначительны силы взаимодействия ионов из-за их отдаленности друг от друга, можно принять ƒ=1, и тогда, а=С.
Таким образом, коэффициент активности показывает, как поведение ионов в растворе электролита при данной концентрации отклоняется от их поведения при бесконечном разведении раствора.
Следует отметить, что коэффициент активности зависит не только от концентрации данного электролита, но и от концентрации других ионов, находящихся в этом растворе, и его величина понижается с возрастанием ионной силы раствора (I). Ионная сила является мерой электростатического взаимодействия между всеми ионами в растворе и вычисляется по формуле:
I = ½ (С1Z12 + C2Z22 +... + CiZi2)
где С1,С2 и Сi – молярные концентрации отдельных ионов в растворе, Z1, Z2, Zi –заряды ионов.
Зависимость коэффициента активности от ионной силы раствора выражается приближенной формулой Дебая-Гюккеля:
lgƒ = -0,5 Z2√I
В более концентрированных растворах (> 0,1 н.) между заряженными ионами возникает взаимодействие не только электростатического, но и химического порядка.
Электропроводность растворов электролитов характеризуют эквивалентной и удельной электропроводностью.
Эквивалентная электропроводимость λV растворов электролитоврассчитывается по формуле:
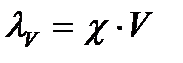
где V – разведение, объем раствора в см3, содержащего 1 эквивалент растворенного вещества; χ – удельная электропроводность раствора. Данная зависимость может быть выражена и через концентрацию:

Предельная эквивалентная электропроводимость раствора может быть представлена суммой предельных электрических проводимостей, или предельных подвижностей ионов:

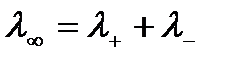
где λ+ и λ- - предельная эквивалентная электрическая проводимость, или предельная подвижность соответственно катиона и аниона. Данное выражение является законом независимого движения ионов, установленном в 1879 г. Ф.Кольраушем.
Степень электролитической диссоциации сильных и слабых электролитов зависит от электрической проводимости:

Зная константу, можно рассчитать концентрации ионов водорода и гидроксид-ионов:
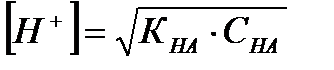

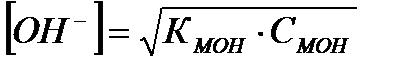
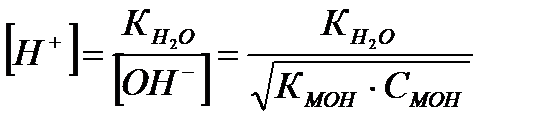
где рК=-lgК и рС=-lgС; КНА и КМОН – константы диссоциации кислоты и основания соответственно; СНА и СМОН – концентрации кислоты и основания соответственно; [Н+] и [ОН-] – концентрации ионов водорода и гидроксид-ионов; 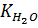 - ионное произведение воды; рН – водородный показатель.
- ионное произведение воды; рН – водородный показатель.
Гидролиз - это реакция ионного обмена между ионами соли и воды. Различают несколько случаев гидролиза: по катиону, по аниону, по катиону и аниону, необратимый гидролиз.
1 Гидролизу по аниону подвергаются соли, образованные сильным основанием и слабой кислотой.
КОН ← КСN → НСN
КСN + Н2О ↔ КОН + НСN,
СN- + Н2О ↔ НСN + ОН-.
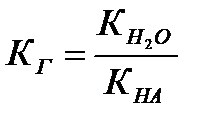
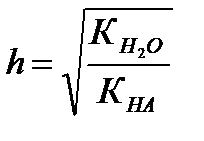
где КГ – константа гидролиза; h – степень гидролиза.
2 Гидролизу по катиону подвергаются соли, образованные сильной кислотой и слабым основанием.
NН4ОН ← NН4CI → НСI

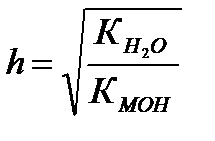
3 Гидролизу по катиону и аниону подвергаются соли, образованные слабым основанием и слабой кислотой.
NH4ОН ← НN4(CH3COO) → CH3COOH
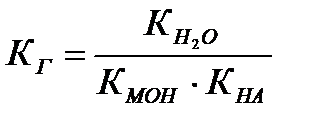

4 Необратимый гидролиз. В таблице «Растворимость кислот, оснований и солей в воде» вы найдете примечание: «в водной среде разлагаются» - это значит, что такие соли подвергаются необратимому гидролизу. Например, сульфид алюминия А12S3 в воде подвергается необратимому гидролизу, так как появляющиеся при гидролизе по катиону ионы Н+ связываются образующимися при гидролизе по аниону ионами ОН-. Это усиливает гидролиз и приводит к образованию нерастворимого гидроксида алюминия и газообразного сероводорода:
А12S3 + 6Н2О = 2Аl(ОН)3↓ + ЗН2S↑.
Поэтому сульфид алюминия А12S3 нельзя получить реакцией обмена между водными растворами двух солей, например хлорида алюминия АlСl3 и сульфида натрия Nа2S.
5 Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу: KOH ← KCl → HCl.
 2020-05-12
2020-05-12 152
152








