Атом – наименьшая частица химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронной оболочки, в которой на определенных энергетических уровнях располагаются электроны. Основу квантовой теории атома составляют постулаты Бора:
a) Постулат стационарных состояний в атоме существует набор стационарных состояний, находясь в которых атом не излучает энергию.
b) Правило квантования орбит в стационарном состоянии электрон, двигаясь по круговой орбите, имеет квантованные значения момента импульса, удовлетворяющие условию:  , где m – масса электрона,
, где m – масса электрона,  – скорость электрона,
– скорость электрона,  – радиус орбиты,
– радиус орбиты,  – номер орбиты (1, 2, 3),
– номер орбиты (1, 2, 3), 
c) Правило частот: при переходе электрона с одной орбиты на другую излучается или поглощается один квант с энергией, равной разности энергий, соответствующих стационарным состояниям атома:  ,
, 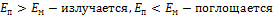 , состояние электрона в атоме определяется четырьмя квантовыми числами,
, состояние электрона в атоме определяется четырьмя квантовыми числами,  .
.  определяет энергетические уровни электрона,
определяет энергетические уровни электрона,  – основное,
– основное,  – возбужденное.
– возбужденное.  определяет моменты импульса электрона атома.
определяет моменты импульса электрона атома.  определяет проекцию момента импульса электрона на заданное направление внешнего магнитного поля.
определяет проекцию момента импульса электрона на заданное направление внешнего магнитного поля.  определяет проекцию спина электрона на заданное направление внешнего магнитного поля. Спин – собственный механический момент импульса электрона, не связанный с его движением в пространстве. Физический смысл квантовых чисел: n, l характеризуют форму и размеры электрического облака, а
определяет проекцию спина электрона на заданное направление внешнего магнитного поля. Спин – собственный механический момент импульса электрона, не связанный с его движением в пространстве. Физический смысл квантовых чисел: n, l характеризуют форму и размеры электрического облака, а  ,
,  характеризует ориентацию облака в пространстве. Распределение электрона в атоме по энергетическим уровням подчиняется принципу Паули: в атоме не может быть более 1 электрона с одинаковым набором 4 квантовых чисел. Совокупность электронов во многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называется электронной оболочкой. В каждой оболочке подразделяется по подоболочкам, соответствующим данному значению квантового числа l. Количество электронов в подоболочках определяется
характеризует ориентацию облака в пространстве. Распределение электрона в атоме по энергетическим уровням подчиняется принципу Паули: в атоме не может быть более 1 электрона с одинаковым набором 4 квантовых чисел. Совокупность электронов во многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называется электронной оболочкой. В каждой оболочке подразделяется по подоболочкам, соответствующим данному значению квантового числа l. Количество электронов в подоболочках определяется  ,
,  .
.
 2020-05-12
2020-05-12 207
207








