Перед рассмотрением кислотно – оснóвного титрования следует вспомнить некоторые положения протолитической теории, которая основана на особенностях иона водорода. В соответствии с этой теорией вещества, способные отдавать протон, называются кислотами, а вещества, принимающие протон – основаниями. Вещества, способные быть и донором, и акцептором протона, называют амфолитами. Кислотами, основаниями и амфолитами могут быть незаряженные и заряженные соединения. Например:
Кислота Основание Амфолит
HCl Cl−
HCOOH HCOO−
CH3COOH CH3COO−
 NH3
NH3
H2CO3 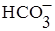
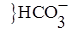
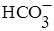

H3O+ H2O

H2O OH−
Обратимые реакции с переносом протона р от кислоты НА к основанию В называют кислотно ─ оснóвными полуреакциями:


Кислота и получившееся при отдаче протона основание составляют
сопряженную пару. В приведенных уравнениях это НА и А−, ВН+ и В.
Очевидно, что полуреакции в растворах неосуществимы: кислота может отдать протон только в присутствии акцептора протона. Все вещества лишь потенциально могут быть кислотами или основаниями. Проявить свои кислотные или оснóвные свойства они могут лишь в протолитической реакции, объединяющей полуреакции:
НА + В  ВН+ + А− (4.13)
ВН+ + А− (4.13)
кислота 1 основание 2 кислота 2 основание 1
Согласно уравнению (4.13), при взаимодействии кислоты и основания образуются новые кислота и основание ─ «нейтрализации» в смысле исчезновения кислоты и основания нет.
Одним из компонентов протолитической реакции может быть растворитель, например, вода, которая относится к амфипротным (амфотерным) растворителям, обладающим как кислотными, так и основными свойствами.
Важнейшей особенностью амфипротных растворителей является способность к передаче протона от одной молекулы растворителя, в общем случае  , к другой:
, к другой: 
В случае воды: 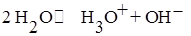
Процессы, в которых одна молекула растворителя проявляет свойства
кислоты, а другая ─ основания, называют автопротолизом. Характеристикой равновесия автопротолиза является константа автопротолиза.
Константа автопротолиза воды  или
или  называется ионным
называется ионным
произведением воды: 
При взаимодействии с амфипротными растворителями растворенные вещества могут проявлять как кислотные, так и оснóвные свойства. Например, в воде:
1. 
2. 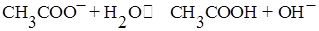
3. 
4. 
Вторая и третья реакции в рамках теории Аррениуса называются реакциями гидролиза, который является частным случаем кислотно – оснόвного равновесия и представляет собой реакцию диссоциации заряженных оснований (например, основания  ─ реакция 2) и кислот (например, кислоты
─ реакция 2) и кислот (например, кислоты  ─ реакция 3) в воде.
─ реакция 3) в воде.
Кислотно ─ оснóвное титрование – быстрый и точный метод количественного определения веществ, обладающих кислотными или оснóвными свойствами. Этим методом определяют десятки неорганических кислот и оснований и сотни различных органических соединений, обладающих кислотными и основными свойствами. Кроме того, существует ряд методик количественного определения ионов металлов и неметаллов кислотно ─ оснóвным титрованием
В основе метода при титровании в водных растворах лежат
протолитические реакции:
при титровании сильной кислоты сильным основанием или наоборот: Н3О+ + ОН─  2Н2О
2Н2О
при титровании слабой кислоты сильным основанием:
НA + ОН─  A─ + Н2О,
A─ + Н2О,
например, 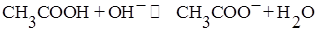
при титровании слабого основания сильной кислотой:
B + Н3О+  BH+ + Н2О, например,
BH+ + Н2О, например,  )
)
Напомним, что в расчетных формулах (кроме уравнений реакций) для
упрощения вместо иона гидроксония Н3О+ обычно пишут Н+, подразумевая, что в растворе протон существует в сольватированном состоянии. Для простоты расчетов также полагают коэффициенты активности равными единице.
Методы кислотно – оснόвного титрования классифицируют на подгруппы: ацидиметрические методы, в которых титрантами являются стандартные растворы HCl и H2SO4 (реже – HClO4 или CH3COOH) и
алкалиметрические методы, в которых титрантом обычно является стандартный раствор NaOH.
Концентрация стандартных растворов обычно составляет 0.05‑0.5 моль∙л−1, а титруемые растворы часто разбавляют до концентраций порядка 0.01 моль∙л−1 , что позволяет при количественных расчетах рН и построении кривых титрования пренебречь разбавлением раствора аналита.
Концентрация стандартного раствора, используемого в качестве титранта, обычно определяется с относительной погрешностью, которая не должна превышать ±0.1%. Приготовить стандартные растворы HCl и H2SO4 с такой точностью из выпускаемых промышленностью концентрированных кислот путем прямого разбавления невозможно, т.к. сертификаты (паспортные данные) этих реактивов имеют малодостоверные данные о содержании основного компонента. Поэтому сначала, путем разбавления, готовят раствор будущего титранта примерно интересующей химика концентрации, а затем проводят его стандартизацию по одному из первичных стандартов, имеющих известный стехиометрический состав, точное содержание основного компонента и химически устойчивого на воздухе.
В ацидиметрии такими первичными стандартами (установочными веществами) обычно являются безводная сода Na2CO3 или бура Na2B4O7·10H2O:
Na2CO3 + HCl = NaHCO3 + NaCl
Na2CO3 + 2HCl = 2NaCl + H2CO3
Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4H3BO3
В алкалиметрии нельзя приготовить стандартные растворы NaOH или KOH путем взятия даже точной навески и растворением ее в точном объеме дистиллированной воды, т.к. препараты NaOH и KOH имеют также достаточно неопределенный состав из – за сильного поглощения влаги и углекислого газа из воздуха. В этом случае рассчитывают примерную навеску препарата, которую необходимо растворить в дистиллированной воде для получения примерно интересующей химика концентрации, а затем проводят стандартизацию по одному из первичных стандартов: гидрофталату калия COOHC6H4COOK или щавелевой H2C2O4·2H2O или бензойной (C6H5COOH) кислоте:
COOHC6H4COOK + NaOH = NaOOCC6H4COOK + H2O
H2C2O4·2H2O + 2NaOH = Na2C2O4 + 4H2O
C6H5COOH + NaOH = C6H5COONa + H2O
Для выбора подходящего кислотно – оснόвного индикатора, с помощью которого регистрируют КТТ, в кислотно – оснόвных титрованиях строят, как правило, монологарифмические кривые титрования в координатах:
рН (– lg[H+]) = f (τ%) или рН (– lg[H+]) = f (V).
Основными точками на кривой титрования являются: точка начала титрования, точка эквивалентности и несколько точек до и после нее, включая точки начала и конца скачка титрования.
Вычисление концентрации ионов водорода обычно производят с точностью до двух значащих цифр. Такая точность вполне достаточна для выбора индикатора и оценки индикаторных погрешностей титрования.
4.2. Кислотно ‒ оснóвные индикаторы (рН ‒ индикаторы)
Достижение конечной точки титрования устанавливают, как правило, электрохимическими методами (потенциометрически) или с помощью
кислотно ‑ оснóвных индикаторов (pH ‒ индикаторов), которые изменяют свой цвет вблизи точки эквивалентности. Момент, который соответствует резкому изменению окраски индикатора, является конечной точкой титрования. Чем ближе КТТ к точке эквивалентности, тем правильнее (точнее) будет результат анализа.
Разные индикаторы изменяют свой цвет при разных значениях pH. Следовательно, правильный выбор pH ‒ индикатора является одним из наиболее ответственных моментов при титровании. По своей химической природе большинство кислотно – оснóвных индикаторов является сложными органическими соединениями. Молекулы pH – индикаторов обладают слабыми кислотными или оснóвными свойствами, причем окраска недиссоциированных молекул отличается от окраски образуемых ими ионов, то есть кислотная и оснóвная форма имеют различную окраску. Попутно заметим, что рН – индикаторы бывают одноцветные (например, фенолфталеин), двухцветные (например, метиловый оранжевый) и многоцветные. Как и для любой кислоты (или основания), для pH ‒ индикатора можно записать константу кислотности (диссоциации):
HInd + Н2О  H3О+ + Ind–
H3О+ + Ind–
окраска 1 окраска 2
(кислотная форма) (оснóвная форма)

и, через pH, 
Разница в окрасках кислотной и оснóвной форм индикатора объясняется тем, что они по разному поглощают свет различных длин волн. Изменение pH раствора вызывает изменения отношения концентраций кислотной и оснóвной форм. Если интенсивность окраски обеих форм индикатора примерно одинаковы, то глаз замечает присутствие только одной формы в том случае, когда концентрация этой формы в 10 или более раз превышает концентрацию другой формы:
если 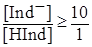 , то глаз видит окраску оснóвной формы,
, то глаз видит окраску оснóвной формы,
если  , то глаз видит окраску кислотной формы,
, то глаз видит окраску кислотной формы,
если  , то глаз видит смешанную окраску обеих форм.
, то глаз видит смешанную окраску обеих форм.
 2020-05-11
2020-05-11 91
91







