(на примере титрования уксуснойкислоты стандартным раствором NaOH)
При этом следует помнить, что:
А) равновесная концентрация ионов водорода не равна аналитической
концентрации кислоты: 
Б) в процессе титрования образуется буферный раствор, состоящий из смеси слабой кислоты 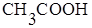 и сопряженного основания
и сопряженного основания  (из смеси слабой кислоты и ее соли);
(из смеси слабой кислоты и ее соли);
В) в ТЭраствор содержит только основание  (анион кислоты) в количестве, равном количеству титруемой кислоты.
(анион кислоты) в количестве, равном количеству титруемой кислоты.
Поэтому схема расчета значения pH для каждой точки кривой титрования включает:
1. Определение состава раствора
2. Рассмотрение возможных протекающих реакций
3. Вывод расчетных формул, исходя из значений:
– константы (констант) кислотности
– константы (констант) оснóвности, аналитических и равновесных
концентраций компонентов.
Для расчета значений pH в различных точках кривой титрования и ее
построения необходимо вывести четыре формулы для:
1 расчета  ; (pH) раствора слабой кислоты перед началом титрования;
; (pH) раствора слабой кислоты перед началом титрования;
2 расчета  ; (pH) в процессе титрования в интервале 0 < τ < 100%, когда
; (pH) в процессе титрования в интервале 0 < τ < 100%, когда
в растворе присутствует слабая кислота и ее соль, образуя буферный
раствор;
3 расчета  ; (pH) в точке эквивалентности (стехиометричности), когда
; (pH) в точке эквивалентности (стехиометричности), когда
в растворе находится только соль слабой кислоты и сильного основания;
4 расчета  ; (pH) после точки эквивалентности (стехиометричности).
; (pH) после точки эквивалентности (стехиометричности).
В соответствии с приведенной схемой рассмотрим процесс титрования
раствора  стандартным раствором NaOH.
стандартным раствором NaOH.
Анализ кривых титрования сильных и слабых кислот и оснований показывает:
1. В разных случаях ТЭ соответствует разным значениям рН, т.е. титрование приходится заканчивать при разных значениях рН. Конкретное
значение рН, соответствующее ТЭ, зависит от природы титранта,
 2020-05-11
2020-05-11 116
116








