| Li, K, Ba, Ca, Na, | Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb | H 2 | Cu, Hg, Ag, Pt, Au |
| активные металлы | металлы средней активности | неактивные металлы |
Металлические элементы, образующие химически активные металлы (Li–Mg), в природе чаще всего встречаются в виде солей (хлоридов, фторидов, сульфатов, фосфатов и других).
Соли, образуемые этими металлами, являются главной составной частью распространённых в земной коре минералов и горных пород.

| 
| 
|
| Сильвин — хлорид калия KCl с примесями | Минерал галит состоит из хлорида натрия NaCl | Минерал кальцит состоит из карбоната кальция CaCO_3 |
В растворённом виде соли натрия, кальция и магния содержатся в природных водах. Кроме того, соли активных металлов — важная составная часть живых организмов. Например, фосфат кальция Ca 3(PO 4)2 является главной минеральной составной частью костной ткани.
Металлические химические элементы, образующие металлы средней активности (Al–Pb), в природе чаще всего встречаются в виде оксидов и сульфидов.

| 
| 
|
| Минерал корунд состоит из оксида алюминия Al_2O_3 | Оксид железа(III) Fe_2O_3 образует минерал гематит | Минерал галенит cостоит из сульфида свинца(II) PbS |
Металлические элементы, образующие химически неактивные металлы (Cu–Au), в природе чаще всего встречаются в виде простых веществ.

| 
| 
|
| Самородное золото Au | Самородное серебро Ag | Самородная платина Pt |
Исключение составляют медь и ртуть, которые в природе встречаются также в виде химических соединений.

| 
| 
|
| Минерал медный блеск состоит из сульфида меди I) Cu_2S | Гидроксокарбонат меди(II) (CuOH)_2CO_3 малахит | Минерал киноварь состоит из сульфида ртути(II) HgS |
Положение элементов металлов в Периодической системе, особенности строения и свойств их атомов
В Периодической системе химических элементов металлы занимают левый нижний угол и находятся в главных (А) и побочных (Б) группах.
Открыть таблицу в большом размере

Положение металлов в Периодической системе. Знаки металлических химических элементов выделены красным цветом
В электронной оболочке атомов металлов на внешнем энергетическом уровне, как правило, содержится от 1 до 3 электронов. Исключение составляют только металлы IV А, V А и VI А группы, у которых на наружном энергетическом уровне находятся соответственно четыре, пять или шесть электронов.
Радиусы атомов металлов больше, чем у атомов неметаллов того же периода. В силу отдалённости положительно заряженного ядра атомы металлов слабо удерживают свои валентные электроны (электроны внешнего энергетического уровня).
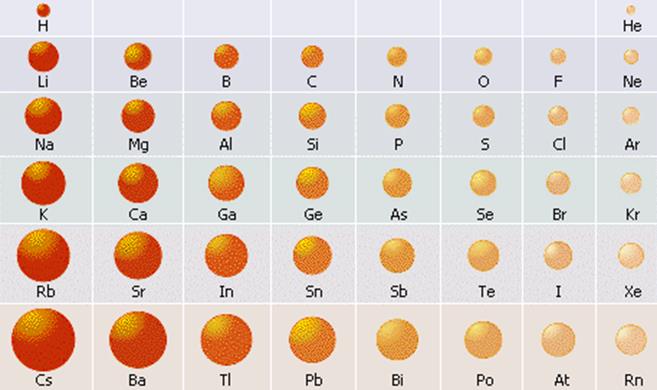
Характер изменения радиусов атомов химических элементов в периодах и в группах. Радиусы атомов металлов существенно больше, чем радиусы атомов неметаллов, находящихся в том же периоде
Главное отличительное свойство металлов — это их сравнительно невысокая электроотрицательность (ЭО) по сравнению с неметаллами.
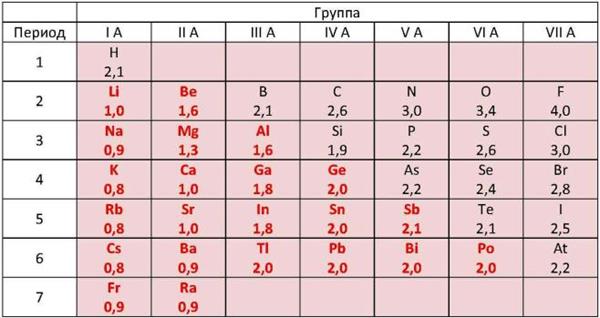
Величины относительных электроотрицательностей (ОЭО) некоторых химических элементов (по Л. Полингу). ОЭО металлических химических элементов (выделены красным цветом) уступает соответствующей величине неметаллических химических элементов
Атомы металлов, вступая в химические реакции, способны только отдавать электроны, то есть окисляться, следовательно, в ходе превращений могут проявлять себя в качестве восстановителей.
 2020-05-12
2020-05-12 704
704







