Введение
Слово “коррозия” происходит от латинского “corrodere”, что означает “разъедать”. Хотя коррозию чаще всего связывают с металлами, но ей подвергаются также камни, пластмассы и другие полимерные материалы и дерево. Например, в настоящее время мы являемся свидетелями большого беспокойства широких слоев людей в связи с тем, что от кислотных дождей катастрофически страдают памятники (здания и скульптуры), выполненные из известняка или мрамора.
Таким образом, коррозией называют самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды. Процессы физического разрушения к коррозии не относят, хотя часто они наносят неменьший вред памятникам культуры. Их называют истиранием, износом, эрозией.
Металлы составляют одну из основ цивилизации на планете Земля. Среди них как конструкционный материал явно выделяется железо. Объем промышленного производства железа примерно в 20 раз больше, чем объем производства всех остальных металлов, вместе взятых. Широкое внедрение железа в промышленное строительство и транспорт произошло на рубеже XVIII…XIX вв. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Однако начало практического использования человеком железа относят к IX в. до н.э. Именно в этот период человечество из бронзового века перешло в век железный. Тем не менее история свидетельствует о том, что изделия из железа были известны в Хеттском царстве (государство Малой Азии), а его расцвет относят к XIV…XIII вв. до н.э.
В природе, хотя и очень редко, но встречается самородное железо. Его происхождение считают метеоритным, т.е. космическим, а не земным. Поэтому первые изделия из железа (они изготавливались из самородков) ценились очень высоко – гораздо выше, чем из серебра и даже золота.
Несмотря на широкое внедрение в нашу сегодняшнюю жизнь полимерных материалов, стекла, керамики, основным конструкционным материалом продолжает оставаться железо и сплавы на его основе. С изделиями из железа мы на каждом шагу встречаемся в быту и знаем, как много хлопот доставляют его ржавление и сама ржавчина. Ржавлением называют только коррозию железа и его сплавов. Другие металлы корродируют, но не ржавеют. Хотя корродируют практически все металлы, в повседневной жизни человек чаще всего сталкивается с коррозией железа.
Строгие расчеты показывают, что большинство металлов имеет склонность к коррозии. Поэтому удивительно не то, что металлы корродируют, а то, что изделия из них могут существовать длительное время. Скорость, с которой протекает коррозия, не поддается теоретическому вычислению. Как правило, она определяется опытным путем. Скорость прежде всего зависит от характера образующихся продуктов коррозии и прочности их сцепления с металлом.
Корро́зия — это самопроизвольное разрушение металлов и сплавов в результате химического, электрохимического или физико-химического взаимодействия с окружающей средой.
В повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление» — коррозия железа и его сплавов с образованием продуктов коррозии, состоящих из гидратированных остатков железа.
На неметаллические материалы определение коррозии не распространяется. Применительно к полимерам существует понятие «старение», аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных осадков, а также биологическая коррозия.
Скорость коррозии, как и всякой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100 градусов может увеличить скорость коррозии на несколько порядков.
Классификация видов коррозии
Неравномерная атмосферная коррозия
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Поэтому пока нет единой и всеобъемлющей классификации встречающихся случаев коррозии.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов:
газовая коррозия;
атмосферная коррозия;
коррозия в неэлектролитах;
коррозия в электролитах;
подземная коррозия;
био-коррозия;
коррозия под воздействием блуждающих токов.
По условиям протекания коррозионного процесса различаются следующие виды:
контактная коррозия;
щелевая коррозия;
коррозия при неполном погружении;
коррозия при полном погружении;
коррозия при переменном погружении;
коррозия при трении;
межкристаллитная коррозия;
коррозия под напряжением.
По характеру разрушения:
сплошная коррозия, охватывающая всю поверхность:
равномерная;
неравномерная;
избирательная;
локальная (местная) коррозия, охватывающая отдельные участки:
пятнами;
язвенная;
точечная;
сквозная;
межкристаллитная (расслаивающая в деформированных заготовках и ножевая в сварных соединениях).
Главная классификация производится по механизму протекания процесса. Различают два вида:
химическую коррозию;
электрохимическую коррозию.
Пассивация металлов
Каждый школьник знает, что серная кислота взаимодействует с железом в соответствии с уравнением:
Fe + H2SO4 = FeSO4 + H2
Несколько иначе идет реакция железа с HNO3:
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O
Вероятно, многие обратили внимание на то, что серную и азотную кислоты перевозят по железной дороге в стальных цистернах. Об этом свидетельствуют надписи, например «Осторожно, серная кислота». Как это согласуется с теми знаниями, которые отражены в школьных учебниках? Все дело в том, что по железной дороге перевозят не разбавленные, а концентрированные кислоты. Зачем же перевозить воду? Разбавить кислоту можно и на месте потребления.
Оказывается, что в отличие от разбавленных концентрированная серная, так же как и концентрированная азотная кислоты, не взаимодействует с железом. Правильнее сказать, что кратковременное взаимодействие происходит, но оно быстро прекращается. Специалисты говорят, что в крепких растворах этих кислот железо пассивируется. Еще в 1836 г. знаменитый английский химик М. Фарадей высказал предположение, что причиной пассивации является образование на поверхности металла плотной оксидной пленки. В свое время на это предположение не обратили должного внимания. Лишь через 100 лет эти взгляды возродил и развил известный русский ученый В.А. Кистяковский. После него этот взгляд на пассивацию оформился в виде теории. Согласно ей при пассивации на поверхности металла образуется сплошная и плотная оксидная (реже хлоридная, сульфатная, фосфатная) пленка толщиной в несколько десятков нанометров. Например, на поверхности железа образуется оксидная пленка нестехиометрического состава Fe8O11, Fe3O4.
Имеется и другой взгляд на причину пассивации металлов, согласно которому она обусловлена слоем адсорбированного кислорода или какого-либо другого окислителя. Считают, что при адсорбции происходит насыщение валентности поверхностных атомов металла, что и приводит к снижению его химической активности.
Первая теория наиболее распространена, хотя не исключено, что в разных случаях процессы пассивации согласуются то с одной, а то с другой теорией.
Металлы можно перевести в пассивное состояние не только под действием окислителей, но и электрохимически, подав на них положительный потенциал.
Способность металлов пассивироваться широко используют для их защиты от коррозии. Например, известно, что хранение лезвий безопасных бритв в растворах солей хромовых кислот позволяет дольше сохранять их острыми. В ином случае под действием влажного воздуха железо, особенно на острие лезвия, окисляется и покрывается рыхлым слоем ржавчины.
Пассивируя металл, т.е. создавая оксидные или солевые пленки, можно проводить окраску или тонирование металлов. Толщина таких пленок соизмерима с длиной волны видимого света, поэтому цвет тонированной поверхности зависит от толщины покрытия и цвета металла. Для химического оксидирования с целью окраски широко используют персульфатный раствор, а для электрохимического – изделие делают анодом. В последнем случае говорят, что окрашивание проводят путем анодирования. Тонированию чаще всего подвергают изделия из меди и ее сплавов, а также из алюминия, олова, никеля.
Тонирование может также обусловливаться сульфидной пленкой. Приводим распространенный состав тонирующего раствора: CuSO4 (10…12 г/л), Pb(NO3)2 (10…12 г/л), Na2S2O3 (100…180 г/л), сегнетова соль (15…20 г/л). Тонирование изделий при комнатной температуре в этом растворе позволяет получить следующую цветовую гамму: желтый (5 мин), коричневый (7 мин), красный (10 мин), фиолетовый (13 мин), синий (17 мин), зеленый (20 мин). Электрохимический метод тонирования отличается более широкой цветовой гаммой и лучшей воспроизводимостью цветов по сравнению с химическим.
Издавна известен процесс воронения и синения сталей. По существу, это термический способ их оксидирования. Его проводят на воздухе при температуре 350…3600C. Поверхность изделий предварительно покрывают тонким слоем 15…20%-ного раствора асфальтового лака в бензине и подсушивают на воздухе. Такой же эффект может быть получен при оксидирующей обработке изделий в кипящем растворе щелочи в присутствии нитратов и нитритов щелочных металлов.
К сказанному можно добавить, что оксидирование металлов в промышленных масштабах осуществляют не только для их противокоррозионной защиты и декорировки изделий, но и для придания электроизоляционных свойств поверхностному слою и увеличению коэффициента отражелакировку.
Ингибиторы коррозии металлов
Применение ингибиторов – один из эффективных способов борьбы с коррозией металлов в различных агрессивных средах (в атмосферных, в морской воде, в охлаждающих жидкостях и солевых растворах, в окислительных условиях и т.д.). Ингибиторы – это вещества, способные в малых количествах замедлять протекание химических процессов или останавливать их. Название ингибитор происходит от лат. inhibere, что означает сдерживать, останавливать. Ингибиторы взаимодействуют с промежуточными продуктами реакции или с активными центрами, на которых протекают химические превращения. Они весьма специфичны для каждой группы химических реакций. Коррозия металлов – это лишь один из типов химических реакций, которые поддаются действию ингибиторов. По современным представлениям защитное действие ингибиторов связано с их адсорбцией на поверхности металлов и торможением анодных и катодных процессов.
Первые ингибиторы были найдены случайно, опытным путем, и часто становились клановым секретом. Известно, что дамасские мастера для снятия окалины и ржавчины пользовались растворами серной кислоты с добавками пивных дрожжей, муки, крахмала. Эти примеси были одними из первых ингибиторов. Они не позволяли кислоте действовать на оружейный металл, в результате чего растворялись лишь окалина и ржавчина.
Ингибиторами, не зная того, давно пользовались и на Руси. Уральские оружейники для борьбы с ржавчиной готовили «травильные супы» – растворы серной кислоты, в которыедобавлялись мучные отруби. Одним из наиболее простых ингибиторов
атмосферной коррозии металлов является нитрит натрия NaNO2. Его используют в виде концентрированных водных растворов, а также растворов, загущенных глицерином, оксиэтилцеллюлозой или карбоксиметилцеллюлозой. Нитрит натрия используют для
консервирования изделий из стали и чугуна. Для первой применяют. 25%-ные водные растворы, а для второго – 40%-ные. После обработки (обычно окунанием в растворы) изделия заворачивают в парафиновую бумагу. Лучшим действием обладают загущенные растворы. Срок хранения изделий, обработанных загущенными растворами, увеличивается в 3…4 раза по сравнению с водными растворами.
По данным 1980 г., число известных науке ингибиторов коррозии превысило 5 тыс. Считают, что 1 т ингибитора дает в народном хозяйстве экономию около 5000 руб.
Работа по борьбе с коррозией имеет важнейшее народнохозяйственное значение. Это весьма благодатная область для приложения сил и способностей.
Типы коррозии
Различают 4 основных вида коррозии: электрохимическая коррозия, водородная, кислородная коррозия и химическая.
Электрохимическая коррозия
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. При электрохимической коррозии всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
Коррозионный элемент
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, так называемый коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку. В ней происходит медленное растворение металлического материала с более низким окислительно-восстановительным потенциалом; второй электрод в паре, как правило, не корродирует. Этот вид коррозии особо присущ металлам с высокими отрицательными потенциалами. Так, совсем небольшого количества примеси на поверхности металла с большим редокс-потенциалом уже достаточно для возникновения коррозионного элемента. Особо подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклёпки.
Если растворяющийся электрод коррозионно-стоек, процесс коррозии замедляется. На этом основана, например, защита железных изделий от коррозии путём оцинковки — цинк имеет более отрицательный потенциал, чем железо, поэтому в такой паре железо восстанавливается, а цинк должен корродировать. Однако в связи с образованием на поверхности цинка оксидной плёнки процесс коррозии сильно замедляется.
Примером крупномасштабной электрохимической коррозии может служить происшествие, случившееся в декабре 1967 года с норвежским рудовозом «Анатина»[3] (англ. Anatina), следовавшим из Кипра в Осаку. Налетевший в Тихом океане тайфун привёл к попаданию в трюмы солёной воды и образованию большой гальванической пары: медного концентрата со стальным корпусом судна, который вскоре размягчился, и судно подало сигнал бедствия. Экипаж был спасён подоспевшим немецким судном, а сама «Анатина» еле-еле добралась до порта.
Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией.
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов. Коррозионный элемент образуется и в случае одного металла, если, например, структура его поверхности неоднородна (например, межкристаллитная коррозия).
Химическая коррозия
Химическая коррозия — взаимодействие поверхности металла с коррозионно-активной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае взаимодействия окисления металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом.

Коррозия бетона
Бетон является крепким каменным строительным материалом, состоящим из цемента, наполнителя и связующих веществ. Так как этот материал эксплуатируется в условиях открытой окружающей среды, а также нередко в агрессивно-опасных средах, то он так же подвержен коррозийному износу.
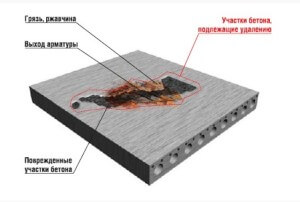
Коррозия представляет собой разъедание строительных материалов под влиянием физических, химических и биологических факторов при контакте с окружающей средой. Бетон имеет в своем составе наименее прочный компонент – это цементный камень. Именно с этой части материала начинается коррозийный процесс. Разрушение случается в результате воздействия различных видов вод, а именно:
сточных;
вод в траншеях или трубах;
морских;
речных;
грунтовых.
Наиболее опасны для бетонов грунтовые воды вблизи промышленных предприятий из-за наличия в них химических выбросов. Также при воздействии с бетоном и железобетоном наносят им весомый вред сточные воды. Коррозия бетона воздействует на гидротехнические сооружения, загрязняет воздух, однако, такая концентрация газа в окружающей среде не вредит здоровью человека, но способствует разрушению бетонных конструкций.
Разрушения строительных материалов разнообразны и могут находиться разрушающие микроорганизмы как в прямом контакте, так и внутри структур. Ускоряется разъедание в бетоне при повышенной влажности окружающей среды.
Виды и описание:
Сульфатная коррозия.
Существуют разновидности бетонной коррозии:
Радиационная, которая зависит от дозы ионизирующего облучения и количества цементного камня. Вследствие чего искажается кристаллическая решетка минералов, расширяется заполнитель, который приводит к микротрещинам, макротрещинам в материале, а в дальнейшем к полному разрушению.
Химическая, происходящая вследствие атмосферных осадков и под воздействием углекислого газа, входящий в состав воздуха. Таким образом, в строительстве бывает газовая коррозия, которая особенно актуальна при большом количестве влаги.
Биологическая. Разъедания, связанные с биологической коррозией, появляются в результате воздействия химических веществ, получившиеся при эксплуатации бетонных конструкций.
Физико-химическая коррозия появляется в результате замерзания воды. В жидком состоянии вода попадает в поры материала, а в результате минусовых температур она замерзает. Образовавшийся лед расширяется и распирает постройки, в итоге образуются трещины.
Вернуться к оглавлению
Химические разъедания
Образуются под взаимодействием бетонного камня с веществами окружающей среды. Процессы химической коррозии относятся к трем категориям:
В результате кристаллизации материалов происходит растрескивание. Трещины являются последствием расширения объема материала из-за низких температур.
Выщелачивание мягкими водами с последующим образованием белого налета.
Цементная бацилла, которая является последствием влаги, разрушает бетонные конструкции. На них образуются трещины и растрескивания.
Физико-химическая
Схема процесса коррозии:
В этом случае цементный камень расходится в воде. В результате чего гидроксид кальция вымывается или растворяется. Растворение железобетона из-за воздействия воды случается с различной быстротой. Так, например, плотные массивные конструкции подвластны коррозии лишь по истечении многих десятилетий. В сооружениях с тонкими оболочками, вымывание кальция случается уже через 2-3 года. В момент прохождения вод через бетон, процесс разложения ускоряется во много раз, и уменьшаются прочностные характеристики материала.
Биологические разрушения
Коррозия с образованием больших объемов биологических соединений в камне, является итогом влияния проникающих в бетон различных веществ. Это способствует появлению внутреннего напряжения и трещин в бетонной конструкции. Биологическая коррозия определяется наличием на цементном камне бактерий, мхов, грибков или лишайников.
Биологические разрушения развиваются из-за прямого контакта микроорганизмов с материалом. А также биоорганизмы, которые могут нанести вред материалу, находясь на расстоянии. Развиваются биологические коррозии в условиях техногенной среды с большим содержанием влаги в атмосфере.
Радиационная
Коррозия бетона бывает радиационной, которая возникает в результате радиационного излучения. Она способствует удалению из бетонной конструкции кристаллизованной жидкости и тем самым приводит к нарушению прочности структуры. Продолжительное воздействие радиационного облучения приводит к жидкому состоянию кристаллических
веществ. Появляется напряжение в бетонном растворе, и возникают трещины.
Факторы влияния:
Коррозия бетона возникает под воздействием следующих обстоятельств, от которых зависит скорость разрушения зданий и сооружений:
· умение поверхности бетонного раствора противодействовать веществам;
· пористость материала;
· вещества, находящиеся в атмосферных осадках;
· капиллярность.
Главная составляющая бетона – это его пористость, которая определяет количество пор и наличие плотности в структуре материала. От пористости бетона зависит возможность влагопоглощения конструкции при таянии снежных масс или других атмосферных осадков. Материал со значительным количеством пор подвластен большей возможности разрушения в результате физико-химической коррозии. Поэтому защита бетона от коррозии должна начинаться на начальном этапе постройки зданий и сооружений, ведь все виды коррозии бетона приводят к разрушению построек.
Коррозия меди:
При эксплуатации медных элементов необходимо учитывать причины коррозии, зачастую они обусловлены средой, где находится элемент. Например, в таких средах как: атмосферная, морская вода, при контакте с галогеновыми веществами и в слабых растворах солей медь коррозирует стабильно медленно.
1)Cu+2H2SO4→CuSO4+SO2↑+2H2O
2)Cu+H2SO4→CuO+SO2↑+H2O
Также медь подвергается коррозии в обычных атмосферных условиях:
2Cu+H2O+CO2+O2→ CuCO3*Cu(OH)2
Методы и способы защиты металлов от коррозии
Вследствие того, что коррозийный процесс протекает на верхних слоях металла конструкции, то защита поверхности заключается в создании верхнего защитного слоя для изделия, который убирает следы коррозии на металле. Такими защитными покрытиями выступают вещества металлические и неметаллические.
Важно понимать, что защита от коррозии не избавляет от нее, а лишь замедляет уже происходящие процессы. Однако, если верно подобрать средство борьбы, то возможно замедлить процесс образования коррозии на несколько лет.
Исходя из названия, металлические покрытия – это вещества, в основе которых металл. Например, чтобы защитить конструкцию из железа от коррозии на ее поверхность наносят слои цинка, меди или никеля.
Неметаллические покрытия – специальные вещества, наиболее широкая группа защитных соединений. Они изготавливаются в виде красок, эмалей, смазок, грунтовок, составов на битумной и битумно-полимерной основе и т.д.
Большая популярность неметаллических соединений в устранении следов коррозии заключается в их широком выборе, большом ценовом диапазоне, легкости изготовления и хороших защитных свойствах.
Наименьшую популярность приобрели химические покрытия из-за необходимости проводить сложные химические процессы:
· Оксидирование – образование оксидных пленок на поверхностях защищаемых деталей.
· Азотирование – насыщение верхних слоев материала азотом.
· Цементация – реакция, при которой верхние слои соединяются с углеродом и т.д.
Также при коррозии металлов существуют способы защиты, при которых на этапе сплавления металлов в них вводят специальные соединения, которые смогут повысить коррозийную устойчивость будущего материала.
Большую группу защиты представляют способы электрохимической и протекторной защиты.
Электрохимическая защита состоит в процессе преобразования продуктов коррозии в среде электролитов с помощью проводящего электрического тока. Постоянный ток присоединяется к катоду (защищаемому материалу), а в качестве анода выступает проводящий металлический источник, который при своем разрушении защищает объект от ржавчины.
Электрохимическая защита от коррозии
Протекторная защита протекает по такому же принципу, однако вместе металлического связующего изделия выступают специальные изделия – протекторы, которые выступают в роли анода. В результате протекающей реакции, протектор разрушается, защищая катод (конструкцию из металла).
Таким образом, хоть коррозия является необратимым процессом, но на данный момент люди научились эффективно замедлять ее губительное воздействие.
Вследствие коррозии теряется большое количество сплавов на основе железа. Каждая пятая тонна из выплавленных черных металлов расходуется на восполнение потерь от коррозии.
Различают два вида коррозии: химическую и электрохимическую.
Химическая коррозия возникает в результате воздействия на металл сухих газов при повышенной температуре (газовая коррозия) и агрессивных жидкостей неэлектролитов (топливо, масло). При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем, находящимся в окружающей среде. Примером химической коррозии может служить окисление клапанов двигателя внутреннего сгорания, топливных баков, трубопроводов и деталей системы питания автомобильных двигателей.
В процессе газовой коррозии на поверхности металла образуется пленка оксида. У алюминия, хрома, никеля, свинца, олова эта пленка очень прочна и предохраняет металл от дальнейшей коррозии. Такие металлы называют пассивирующимися. Пленка оксида железа непрочна и не препятствует развитию коррозии вглубь. Образование окалины на деталях выпускной системы автомобиля наглядно демонстрирует распространение химической коррозии в глубь изделий. В неэлектролитах коррозия происходит вследствие наличия в них агрессивных соединений, разрушающих металл.
Электрохимическая коррозия является результатом воздействия таких электролитов, как водные растворы кислот, щелочей, различных солей, проводящих электрический ток. Электролитической коррозией является также атмосферная коррозия, при которой влага из воздуха, содержащая оксиды азота, серы и другие примеси, конденсируется на поверхности металла.
 2020-05-11
2020-05-11 264
264






