Это уравнение связывает параметры состояния р, Т, М, V.
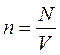 ,
, 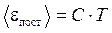
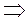
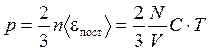
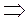
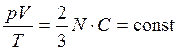
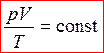 - уравнение Менделеева – Клапейрона (5)
- уравнение Менделеева – Клапейрона (5)
1-й закон Авогадро: киломоли всех газов при нормальных условиях занимают одинаковый объем, равный 22,4 м 3 /кмоль. ( Если температура газа равна T0 = 273,15 К (0 °С), а давление p0 = 1 атм = 1,013·105 Па, то говорят, что газ находится при нормальных условиях.)
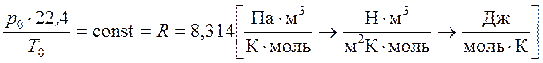
Уравнение Менделеева – Клапейрона для 1 моля газа
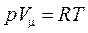 . (6)
. (6)
Уравнение Менделеева – Клапейрона для произвольной массы газа
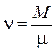 - число молей.
- число молей. 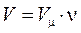 ,
, 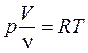
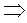
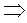
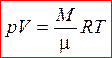 (7)
(7)
Частные случаи уравнения Менделеева – Клапейрона
1. 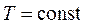
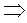
 - изотермическое состояние (закон Бойля – Мариотта)
- изотермическое состояние (закон Бойля – Мариотта)
2. 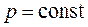
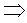
 - изобарное состояние (закон Гей-Люссака)
- изобарное состояние (закон Гей-Люссака)
3. 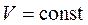
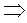
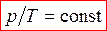 - изохорное состояние (закон Шарля)
- изохорное состояние (закон Шарля)
Энергия термодинамической системы. Первый закон термодинамики. Работа, теплота, теплоемкость, ее виды
Энергия – это количественная мера движения материи.
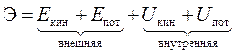 .
.
Внутренняя энергия системы U равна сумме всех видов энергий движения и взаимодействия частиц, составляющих данную систему.
Работа – это способ передачи энергии, связанный с изменением внешних параметров системы.
Теплота – это способ передачи энергии, связанный с изменением внутренних параметров системы.
Различия между теплотой и работой:
1. работа может неограниченно превращаться в любой вид энергии, превращение теплоты ограничено рамками 2-го закона термодинамики: она идет только на увеличение внутренней энергии;
2. работа связана с изменением внешних параметров системы, теплота – с изменением внутренних параметров.
Все три величины – энергия, работа и теплота – в системе СИ измеряются в джоулях (Дж).
 2020-05-13
2020-05-13 174
174








