Решение уравнения Шредингера В квантовой механике строение многоэлектронных атомов объясняется при помощи четырех квантовых чисел, которые однозначно характеризуют движение электрона вокруг ядра.
1. Главное квантовое число n
Тогда уравнение Шредингера для стационарных состояний имеет вид:
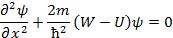
За пределами «ямы» частица попасть не может, поэтому вероятность её обнаружения равна нулю, т.е. нулю равна и функция ψ. Из условия непрерывности следует, что на границах ямы ψ(0)=0 и ψ(L)=0
В пределах «ямы» уравнение Шредингера сведется к уравнению:
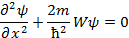
Обозначив 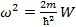 , полчим волновое уравнение
, полчим волновое уравнение
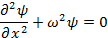
Решение, учитывая граничные условия, дает дискретное значение:
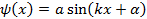
При α=0 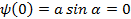
при ωL =±nπ.
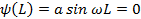
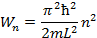
n -главное квантовое числоопределяет энергетические уровни атома, общие для группы электронов и принимает только целочисленные значения от 1 до ∞.
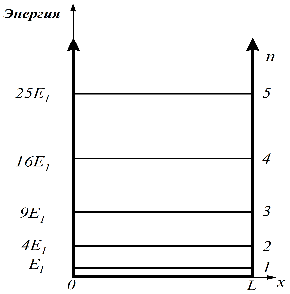
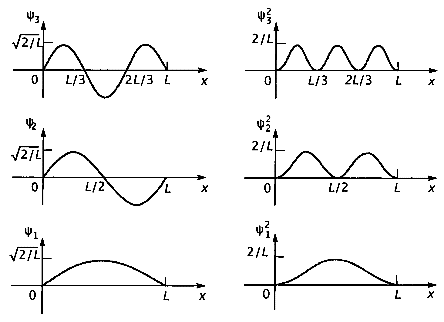
а) энергетический спектр (первые 5 состояний) частицы в потенциальной яме шириной L; б) волновая функция частицы в первых трех состояния; в) квадрат волновой функции частицы = вероятность нахождения частицы в определенной точке потенциальной ямы в первых трех состояниях
Электроны с одинаковым n образуют электронные оболочки с буквенными обозначениями: n=1(K), 2(L), 3(M), 4(N), 5(O), 6(P), 7(Q),… Строго говоря, квантовые числа связаны с волновыми свойствами атомных электронов, но в целях наглядности квантовым числам обычно приписывают также геометрический смысл. В данном случае, главное квантовое число определяет размер орбиты (ее радиус в случае круговой или большую полуось в случае эллиптических орбит). Как мы убедились, у водорода с ростом n увеличивается размер по закону rn~n2.n=1 соответствует основному, невозбужденному состоянию атома водорода, все остальные с n=2,3,…, - возбужденному.
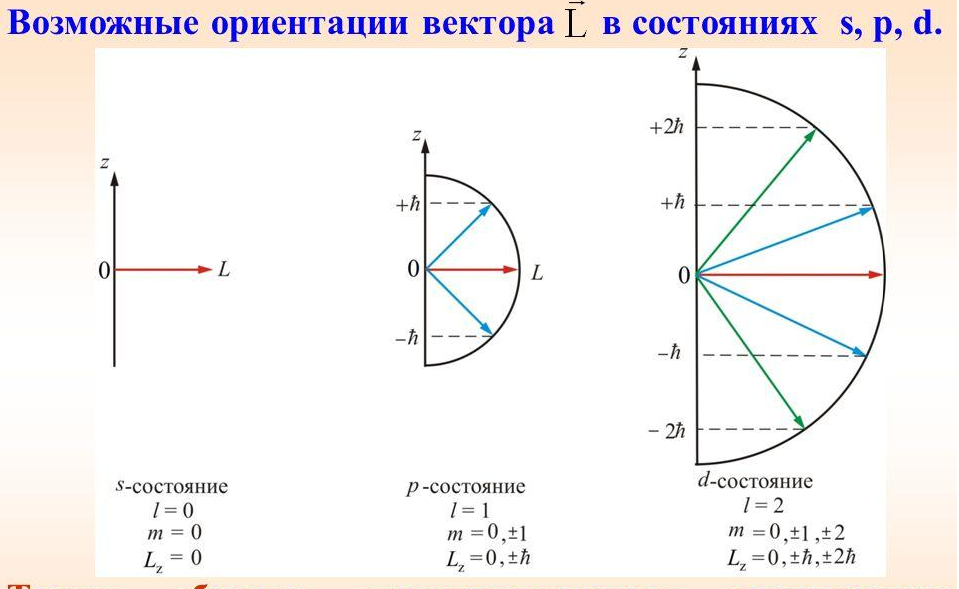
2. Орбитальное (побочное, азимутальное) квантовое число ℓ
определяет энергетические подуровни атома и, при заданном n, принимает целочисленные значения от 1 до n-1 (всего n значения). Электроны с одинаковыми ℓ образуют электронные подоболочки с буквенными обозначениями:
ℓ= 0(s), 1(p), 2(d), 3(f), 4(g), 5(h),…, n-1 (всего n значений) Отсюда видно, что орбитальное квантовое число ℓ не может совпадать с главным квантовым числом n. Орбитальное квантовое число ℓ определяет значение орбитального момента импульса (механический орбитальный момент) электрона. Из квантовой теории вытекает, что момент импульса не может принимать произвольное значение и имеет дискретное значение по формуле:
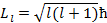
Орбитальное квантовое число ℓ определяет форму орбиты или ее эксцентриситет (расстояние между фокусами эллиптической орбиты). Иными словами, оно обусловливает ее вытянутость. Чем больше ℓ, тем больше вытянута эллиптическая орбита электрона (при ℓ= 0 или s мы имеем дело с круговым вращением электрона. А это означает, что если водород находится в невозбужденном состоянии, то электрон может вращаться только по круговой орбите.
Другие формы орбит появляются, когда электрон поднимается на верхние, возбужденные уровни.
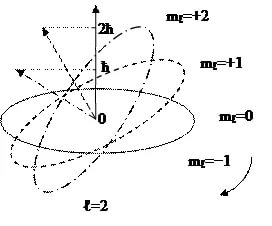
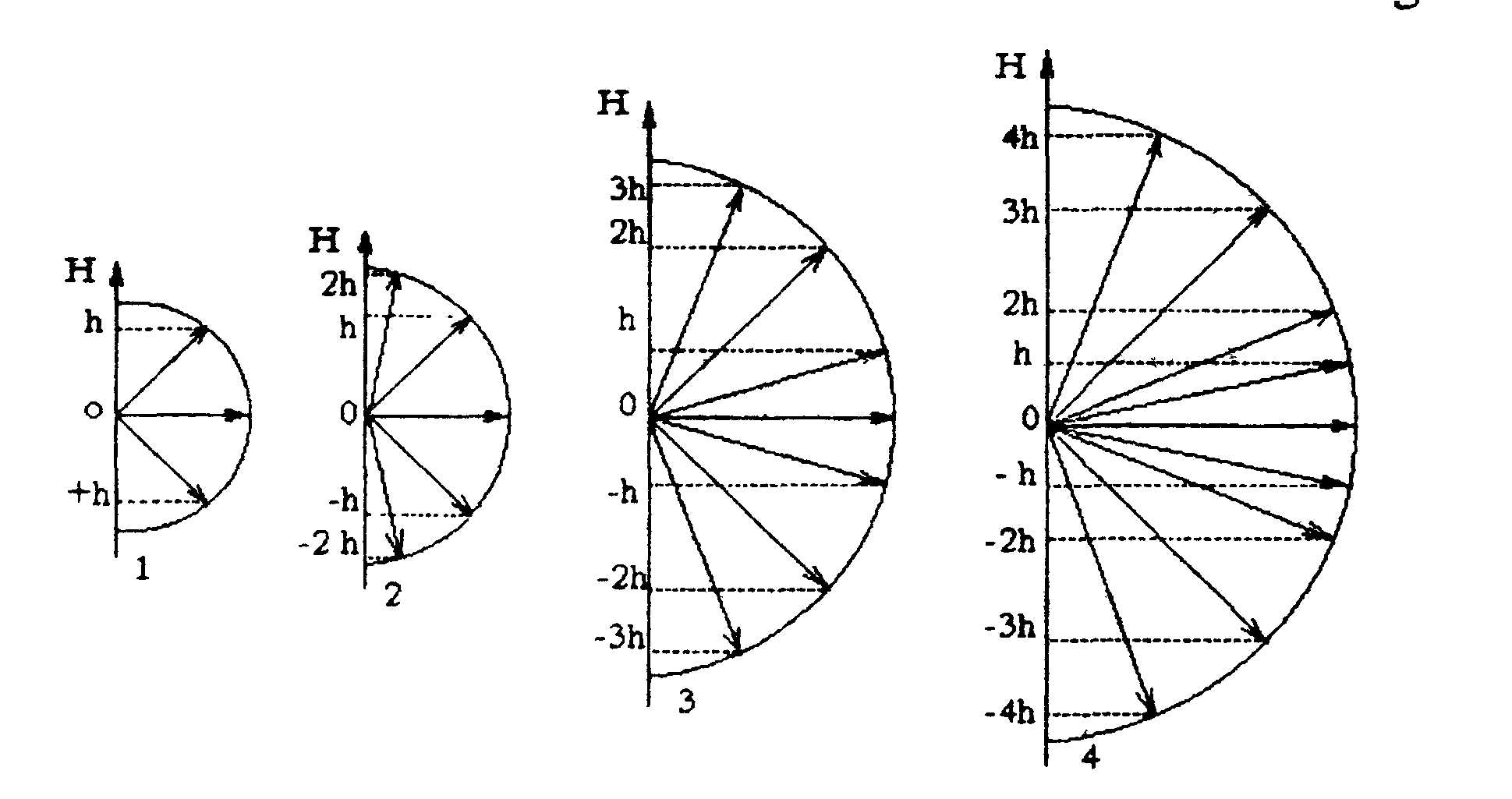
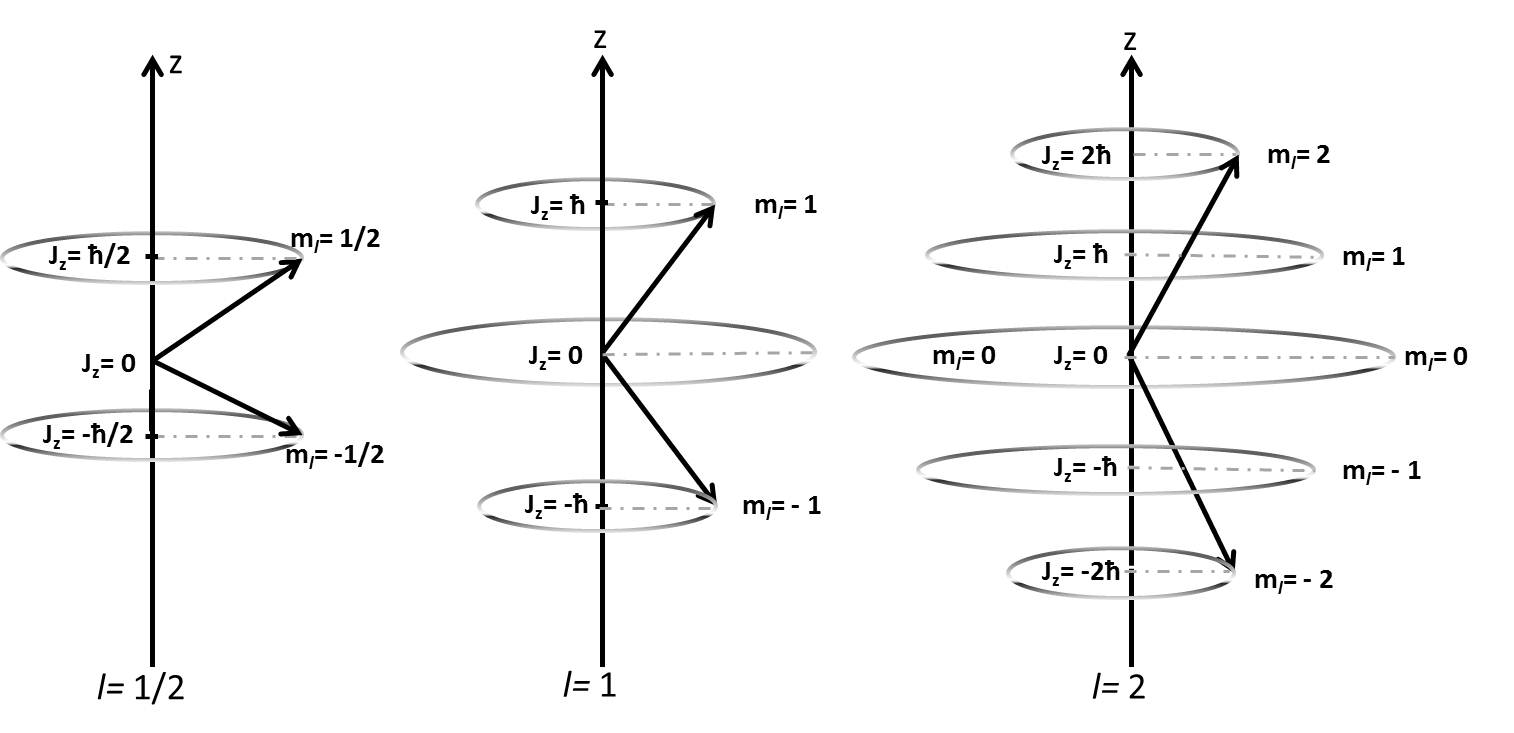
3. Магнитное квантовое число mℓ
определяет возможную пространственную ориентацию орбитального момента, проекция которого на заданное направление z (например на  внешнего магнитного поля) принимает ряд дискретных значении, кратных ħ (пространственное квантование): Lℓz=mℓ.ħ.
внешнего магнитного поля) принимает ряд дискретных значении, кратных ħ (пространственное квантование): Lℓz=mℓ.ħ.
mℓ принимает целочисленные значения от _ ℓ до +ℓ (всего 2 ℓ+ 1 значений): mℓ = 0, ±1, ±2, …±ℓ.
 2020-05-11
2020-05-11 177
177








