Опыты указывают, что силы, удерживающие атомы в молекуле вызваны взаимодействием внешних электронов. Электроны внутренних оболочек при объединении атомов в молекулы остаются в тех же состояниях. Различают два вида связи между атомами в молекуле:
1. Гетерополярная связь (ионная). Электроны располагаются так, что около одного из ядер их избыток, а у других-недостаток. Молекула как бы состоят из двух ионов. (NaCl, KBr, HCl,)
2. Гомеополярная связь (ковалентная или атомная). Часть электронов движется вокруг обоих ядер. Он образуется парами электронов с противоположно-направленными спинами. В молекулах с одинаковыми ядрами (Н2, N2, О2) -электроны распределены симметрично. В молекулах с различными ядрами - (СN) - наблюдается некоторая асимметрия и они обладают электронным дипольным моментом. Если решить уравнение Шредингера для Н2 тогда видно из рисунка следа, что образование молекулы возможно лишь при антипараллельных спинах электронов. При образовании молекулы изменение энергетического запаса происходит в основном в результате изменения электронной конфигурации переферии. Но при заданной электронной конфигурации молекулы могут различным образом колебаться и вращаться относительно общего центра масс. В первом приближении движение электронов, колебание и вращение молекулы можно считать независимыми друг от друга, поэтому полная энергия молекулы: E = Ee + Ео + Ек (где Ee-энергия электрона предопределяет конфигурацию, Eo-энергия обусловлена вращением молекул, Ек-энергия обусловлена колебаниями молекул). При поглощении или излучении кванта энергия молекулы изменяется ΔE = hν. Рассмотрим каждое из слагаемых энергии.
9.3.1.Энергия колебаний.
Различают два типа колебаний атомов в молекуле:
а) валентные колебания атомов вдоль линии связи
б) деформационные колебания – изменяются углы между связями.
Простую двухатомную молекулу можно представить как гармонический осциллятор, то есть частицу, которая осуществляет одномерный движение под действием квазиупругой силы. F= - kx. Потенциальная энергия 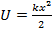 . так как
. так как  т. е.
т. е.  Найдем значение E исходя из волн де Бройля
Найдем значение E исходя из волн де Бройля 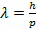 где λ-эффективная длина волны p -эффективный импульс связан с энергией так, как будто потенциальная ловушка отсутствует и частица двигается свободно.
где λ-эффективная длина волны p -эффективный импульс связан с энергией так, как будто потенциальная ловушка отсутствует и частица двигается свободно.
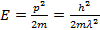 (1)
(1)
из рис. видно, что на каждом уровне укладывается нечетное число λ/4
 ,
,
или  (2)
(2)
перемножим (1) и (2)

или 
Если решить уравнение Шредингера, то точное решение 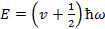 v =0,1,2,3.. –колебательное квантовое число
v =0,1,2,3.. –колебательное квантовое число 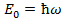 -нулевая энергия Наличие E0 подтверждается эксперименты по рассеянию света кристаллами при низких температурах т. е. при Т=0 движение атомов в кристаллической решетки не прекращается (есть колебания) Строгое решение показало что частица может находиться и за пределами потенциальной ямы то есть там где её полная энергия меньше потенциальной энергии.
-нулевая энергия Наличие E0 подтверждается эксперименты по рассеянию света кристаллами при низких температурах т. е. при Т=0 движение атомов в кристаллической решетки не прекращается (есть колебания) Строгое решение показало что частица может находиться и за пределами потенциальной ямы то есть там где её полная энергия меньше потенциальной энергии.
В квантовой механике показано что для гармонического осциллятора возможны лишь переходы между соседними уровнями то есть Δ v =±1 так как уровни энергии равноудаленные то правило отбор означает, что имеется единственная частота y характерная для данной молекулы  , чем больше k, то есть связь тем более раздвинуты уровне и больше v. То есть по частоте осциллятора можно судить о степени связи атомов в молекуле. Кривая потенциальной энергии молекулы совпадает с параболой только при малых колебаниях. Увеличение интенсивности колебаний приводит к тому, что с увеличением v уровни сгущаются, стремясь к предельному уровню энергии Em– энергии диссоциации. При этом происходит диссоциация молекулы и возникает сплошной спектр.
, чем больше k, то есть связь тем более раздвинуты уровне и больше v. То есть по частоте осциллятора можно судить о степени связи атомов в молекуле. Кривая потенциальной энергии молекулы совпадает с параболой только при малых колебаниях. Увеличение интенсивности колебаний приводит к тому, что с увеличением v уровни сгущаются, стремясь к предельному уровню энергии Em– энергии диссоциации. При этом происходит диссоциация молекулы и возникает сплошной спектр.
9.3.2. Энергия вращения молекулы.
Если вещество находится в газообразном состоянии, то наряду с колебаниями молекулы могут находиться и во вращающемся движении. Если двухатомная молекула вращается вокруг оси проходящей через центр масс, энергия вращения
 E, где L-момент импульса системы J-момент инерции системы Момент импульса может принимать только дискретные значения
E, где L-момент импульса системы J-момент инерции системы Момент импульса может принимать только дискретные значения 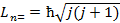
где j = 0,1,2,3,..вращательное квантовое число.
тогда 
для вращающегося квантового числа также существует правило отбора Δ j = ±1. Если молекулу считать жесткой, тогда вращающийся спектр представляет собой ряд равноотстоящих линий, которые соответствуют частотам v; 2v; 3v; и так далее.
так как 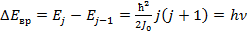 , то разность частот соседних уровней зависит только от момента инерции молекулы
, то разность частот соседних уровней зависит только от момента инерции молекулы

Если определить ν то возможно найти J0 а потом зная массу его атомов определить длину связи r. Вращения более сложных молекул характеризуется J0x; Joy; Joz; что даёт возможность получить информацию о пространственном расположении атомов в молекуле. Вращающийся спектр лежит в ИК области.
Вращающиеся спектры могут давать только молекулы, которые обладают дипольными моментами. электронный уровень-возбужденные УФ или быстрые частицы колебательный уровень-возбужденные ИК или быстрые частицы
Зонная теория кристаллов.
Ранее рассматривалось движение электронов в металлах как в потенциальном ящике с плоским дном. Для всех типов твердых тел характерно правильное расположение атомов или молекул в узлах кристаллической решетки. Расстояние между узлами составляет порядок величины которая сравнима с размерами самих атомов и молекул. В этих условиях атомы или молекулы нельзя рассматривать изолированно. В произвольном кристаллическом твёрдом теле существует периодическое электрическое поле, которое создаётся частицами, которые находятся в узлах кристаллической решетки. то есть в узлах решетки имеются минимумы энергии - "потенциальные ячейки" при приближении атомов происходит расщепление разрешенных уровней на зоны. то есть вместо одного энергетического уровня общего для N атомов в твердом поле возникают N близко расположенных уровней, которые образуют энергетическую полосу или зону энергий.
Взаимодействие между атомами твердого тела сильнее всего влияют на энергетические уровни внешних валентных электронов которые слабее чем остальные связанны со своими ядрами и обладают наибольшей энергией. Энергетические уровни внутри электрона расщепляются очень слабо.
Твердое тело возможно рассматривать как гигантскую молекулу которая состоит из многих атомов.
Энергетическое состояние внутри
Энергетическое состояние внутренних электронов такое же как а отдельных атомах а внешние электроны коллективизованы: они принадлежат все гигантской молекуле и значение энергии этих электронов находится в пределах разрешенных зон. Разрешенные зоны могут быть заполнены полностью частично или полностью свободны. Для перевода электрона с нижней разращённой зоны в соседнюю верхнюю необходимо затратить энергию которая равна/ запретной зоне которая разделяет/ разрешенные зоны. Разрешенную зону, возникшую из того уровня на котором находятся валентные электроны в основном состоянии атома, называют валентной зоной. У металлов валентная зона заполнена не полной и только под действием электрического поля электроны могут осуществлять внутризонные переходы. Аналогично и при перекрытии зон.
Если запрещёная зона ΔE не большая в ширину тогда при заполненной валентной зоны электронам может быть соединена дополнительная энергия электрическим полям. (При условии что з/ться) и электроны перейдут в свободную зону которая / зоной проводимости. Если ширина запретноq зоны ΔE большая то ни тепловое движение, ни электрическое поле не ма/ возможности перевести в свободную зону заметное число электронов i в этом случае кристалл-диэлектрик.
 2020-05-11
2020-05-11 397
397







