МЕТОДЫ ВЫДЕЛЕНИЯ, КУЛЬТИВИРОВАНИЯ И ИДЕНТИФИКАЦИИ ЧИСТЫХ КУЛЬТУР БАКТЕРИЙ
ПОЛУЧЕНИЕ ЧИСТЫХ КУЛЬТУР БАКТЕРИЙ
Чистой культурой называют популяцию микроорганизмов, принадлежащих к одному виду. Примером чистой культуры может служить колония, состоящая из микробных клеток одного и того же вида.
Получение чистых культур необходимо для изучения морфологических, культуральных и биологических свойств выделенного микроорганизма в целях определения его видовой принадлежности. Для выделения чистых культур пользуются методом рассева в глубине питательной среды и методом посева на поверхность питательной среды (метод Дригальского).
Получение чистой культуры методом рассева в глубине среды
Содержимое 3-5 пробирок, в которых находится по 10-15 мл питательного желатина или МПА, расплавляют в водяной бане. Расплавленную среду остужают до 43-45°С и ставят в теплую воду, чтобы предупредить ее застудневание. В одну из пробирок вносят исследуемый материал. Затем пипеткой или петлей содержимое из первой пробирки переносят во вторую, из второй - в третью. Для лучшего перемешивания материала со средой засеянные пробирки, зажав между ладонями, вращают несколько раз в одну и затем в другую сторону. Приготовленные таким образом разведения микроорганизмов выливают из пробирок в чашки Петри, обозначенные номерами, соответствующими номерам пробирок. После застудневания среды с исследуемым материалом чашки помещают в термостат. Количество колоний в чашках с питательной средой уменьшается по мере разведения материала.
Выделение чистой культуры по способу Дригальского
Расплавленную питательную среду с толщиной слоя не менее 0,5 см разливают в 3 чашки Петри. Застывшую среду обязательно подсушивают. В первую чашку вносят небольшое количество исследуемого материала и шпателем Дригальского или шпателем, сделанным из пастеровской пипетки, втирают его в поверхность питательной среды. Далее, не прожигая и не набирая нового материала, шпатель переносят во вторую и в третью чашки, втирая в поверхность питательных сред оставшийся на нем материал.
Метод рассева по поверхности, предложенный Дригальским, является наиболее употребительным для получения чистой культуры микроорганизмов. Вместо шпателя можно пользоваться петлей. Материал на питательной среде распределяют густыми параллельными штрихами по всей чашке в одном направлении. Затем, повернув чашку на 180°, той же петлей проводят штрихи в направлении, перпендикулярном первым штрихам. В результате на поверхности питательной среды вычерчивается густая сетка. При таком способе посева материал, содержащийся на петле, расходуется постепенно, и по линиям сетки, нанесенным в конце посева, вырастают изолированные колонии микробов.
Выделение чистой культуры методом рассева в глубине и на поверхности питательной среды основано на механическом разъединении микроорганизмов, находящихся в исследуемом материале, с целью получения изолированных колоний на плотной питательной среде. Количество микроорганизмов, содержащееся в исследуемом материале, предугадать заранее трудно, поэтому для посева пользуются не одной, а двумя или тремя чашками. При очень большой бактериальной загрязненности материала рост микробов на первой чашке бывает настолько густым, что получить материал из отдельной колонии для выделения чистой культуры невозможно. Тогда для выбора изолированных колоний пользуются второй чашкой. Если же и на ней колонии расположены близко друг к другу, берут чашку с третьим разведением.
Для выделения чистой культуры патогенных микроорганизмов часто пользуются посевом исследуемого материала на элективные и ингибиторные питательные среды.
ИДЕНТИФИКАЦИЯ КУЛЬТУР БАКТЕРИЙ
Идентификацию выделенных бактериальных культур проводят путем изучения морфологии бактерий, их культуральных, биохимических и других признаков, присущих каждому виду.
Культуральные свойства характерны для каждого вида микроорганизма и потому являются важным диагностическим признаком. К данным признакам относятся морфологические особенности колоний бактерий, характер роста на плотных и в жидких питательных средах.
Колонии различаются по величине, форме, цвету, консистенции, контуру края, структуре и характеру поверхности. По величине колонии могут быть крупные (диаметр более 4 - 5 мм), средние (2 - 4 мм) и малые (1 - 2 мм), по форме - круглые, розеткообразные, листовидные и т. д. Цвет колонии зависит от выработки определенного пигмента - белого, желтого, красного и др. Колонии непигментирующих бактерий бесцветны. По консистенции различаются сухие, влажные, сочные или слизистые колонии. Поверхность колонии бывает гладкой, морщинистой, исчерченной, плоской, выпуклой, вдавленной. Край колонии может быть ровным, волнистым, бахромчатым. Колонии могут иметь аморфную, зернистую, волокнистую внутреннюю структуру.
Характер роста бактерий в чистой культуре, выращенной на скошенном питательном агаре, может быть сухим, влажным, «ползучим», складчатым, пигментированным. В жидкой питательной среде одни бактериальные культуры дают диффузное помутнение, другие характеризуются придонным, пристеночным ростом; некоторые культуры образуют пленки на поверхности среды, другие - осадок на дне пробирки.
Свойства культуры изменяются с ее возрастом, поэтому возраст культуры необходимо учитывать и отмечать в протоколе исследования. Возраст культуры, наиболее благоприятный для изучения ее свойств, зависит от видовой принадлежности микроорганизма, так как для появления выраженных признаков роста различным микроорганизмам необходимо разное время. Например, колонии чумной палочки могут быть обнаружены и подвергнуты изучению через 10-12 часов, колонии бактерий туберкулеза - только через несколько недель от момента посева.
Биохимические признаки. Биохимическую активность микробов изучают по характеру и количеству тех ферментов, которые микробная клетка продуцирует и выделяет во внешнюю среду. В жизнедеятельности микробов ферменты играют большую роль. Они являются обязательными участниками разнообразных биохимических реакций, лежащих в основе функций питания, дыхания. Каждый вид микроорганизмов продуцирует постоянный для него по количеству и качеству набор ферментов. Поэтому исследование биохимических свойств микроорганизма является обязательным при определении их видовой принадлежности. Для диагностики микробов наибольшее значение имеет определение сахаролитических и протеолитических ферментов, активирующих соответственно расщепление углеводов и белков.
1. Сахаролитические ферменты микроорганизмов. Свойство расщеплять углеводы и высокоатомные спирты, которые принято объединять в одну группу, именуемую сахарами, присуще многим патогенным микробам. Под действием сахаролитических ферментов бактерий «сахара» расщепляются на альдегиды и кислоты. Конечными продуктами их расщепления являются газообразные, вещества: СО2 и Н2. Отношение микроорганизмов к различным углеводам специфично и поэтому широко применяется в бактериологической практике для дифференциации различных видов и разновидностей бактерий.
Для обнаружения сахаролитических ферментов исследуемую культуру бактерий засевают в питательные среды Гисса, называемые также «пестрым» рядом. Последний представляет собой ряд пробирок с пептонной водой, «сахаром» и индикатором (реактив Андреде или ВР). Короткий «пестрый» ряд Гисса содержит обычно 5 пробирок: с глюкозой, лактозой, маннитом, мальтозой и сахарозой. При некоторых исследованиях для более углубленного изучения биохимических свойств выделенного микроорганизма используют длинный «пестрый» ряд Гисса, в состав которого наряду с перечисленными углеводами входят и другие «сахара»: дульцит, сорбит, ксилоза, арабиноза, крахмал, инулин, гликоген и др.
Название «пестрый» ряд обусловлено тем, что под действием ферментов растущего микроба одни углеводы остаются неизменными и, следовательно, цвет питательной среды не изменяется, в то время как другие сахара расщепляются, образуя кислые продукты распада, которые изменяют цвет индикатора и соответственно цвет питательной среды.
Среды Гисса бывают жидкими и полужидкими. В пробирки с жидкими средами Гисса для обнаружения газов, являющихся конечными продуктами распада сахаров, опускают «поплавок», который представляет собой трубочку диаметром 0,5-0,7 см, запаянную с одного конца. Поплавок опускают запаянным концом кверху, при стерилизации он полностью заполняется питательной средой. При образовании в среде газообразных продуктов последние вытесняют часть находящейся в нем жидкости, вследствие чего у запаянной верхушки поплавка образуется воздушный пузырек различной величины. В полужидких средах Гисса газообразование определяют по наличию мелких пузырьков в толще среды и стойкой пены на ее поверхности.
Таким образом, при изучении сахаролитических ферментов; выделяемых микроорганизмами, учитывают не только явление расщепления тех или иных сахаров по кислотообразованию, но и глубину ферментативного процесса по наличию в питательной среде конечных газообразных продуктов расщепления.
Пробирки с набором сред Гисса ставят в штатив в один ряд. На каждой пробирке надписывают название сахара, содержащегося в среде. На 1-й пробирке каждого ряда, кроме названия сахара, указывают номер или вид испытуемой микробной культуры. Культуру берут на кончик петли в очень небольшом количестве и засевают по общепринятой методике. При переносе петли из пробирки с одной сахарной средой в другую петлю обязательно прожигают, а испытуемую культуру берут заново. Штатив с засеянными средами Гисса ставят в термостат при 37 или 43°С в зависимости от исследуемого материала и цели исследования. После инкубации в термостате учитывают результаты ферментации сахаров.
Изменение цвета питательной среды в пробирке обозначают буквой К, что соответствует образованию в среде кислых продуктов распада сахара. Кислотообразование, сопровождающееся появлением пузырьков газа в поплавке или в толще полужидкой среды, обозначают в протоколе опыта буквами КГ, где буква Г указывает на расщепление сахара с образованием конечных газообразных продуктов его распада.
2. Протеолитические ферменты микроорганизмов. Некоторые микроорганизмы продуцируют и выделяют во внешнюю среду протеолитические ферменты - протеазы, катализирующие расщепление белков. В результате расщепления молекулы белка образуются высокомолекулярные промежуточные продукты распада - пептоны, химическая природа которых изучена недостаточно. Под действием пептолитических ферментов пептоны в свою очередь расщепляются на полипептиды (соединения двух или нескольких аминокислот) и отдельные аминокислоты.
Для выявления протеолитических ферментов исследуемую культуру засевают в питательную среду, содержащую тот или иной белок. Чаще всего для этой цели применяют желатин, реже - свернутую лошадиную сыворотку, коагулированный яичный белок, молоко или кусочки вареного мяса.
Протеолитическая активность одного и того же микроба при определении ее на различных питательных средах будет проявляться неодинаково, что обусловливается специфичностью ферментов. Поэтому для разных видов микробов рекомендуют питательные среды различного состава.
2.1. Определение протеолитической активности микробов на желатине. Мясо-пептонный желатин разливают в пробирки столбиком по 5 - 6 мл. Посев производят уколом, погружая петлю с исследуемой культурой в глубь питательной среды до дна пробирки. Микробы, способные расти при низкой температуре, оставляют стоять в комнате при 20-22°С. Остальные посевы инкубируют в термостате при 37°С. Вместе с опытными пробирками в термостат ставят одну или две пробирки с незасеянным желатином для контроля. При температуре 37° желатин плавится, поэтому после инкубации пробирки, вынутые из термостата, опускают на 30-60 минут в холодную воду или ставят в холодильник. После застудневания желатина в контрольных пробирках приступают к просмотру роста и учету изменений в питательной среде опытных пробирок. Там, где под действием фермента желатиназы произошло расщепление белков желатина, отмечается разжижение питательной среды. Пробирки, в которых после суточного инкубирования среда остается без изменения, оставляют на 6 - 7 дней для ежедневного просмотра. В протоколе исследования обязательно отмечают день появления признаков разжижения среды. При регистрации результатов учитывают интенсивность роста и форму разжижения желатиновой среды.
Разжижение желатина у разных видов микробов происходит неодинаково. Так, например, различают послойное разжижение желатина, при котором последовательно разжижается один горизонтальный слой за другим в направлении сверху вниз. У некоторых видов бактерий отмечают разжижение кратерообразное с вогнутостью поверхности в форме чайного блюдца, воронкообразное. Штаммы, обладающие высокой активностью фермента желатиназы, разжижают весь столбик желатина, находящийся в пробирке.
Некоторые виды патогенных микробов с выраженной протеолитической активностью обладают способностью расщеплять белок и пептон до продуктов глубокого распада: индола, сероводорода, мочевины и аммиака. При определении видов и дифференциации разновидностей патогенных микробов наибольшее значение имеет выявление двух первых продуктов: индола и сероводорода. Индол образуется из сложной гетероциклической аминокислоты - триптофана. Сероводород является конечным продуктом расщепления аминокислот: цистина, цистеина и метионина, содержащих в своем составе серу.
2.2. Определение индола в культуре (По Морелю). Для выявления индолообразования засевают петлю исследуемой культуры микроба в МПБ, приготовленный на переваре Хоттингера, содержащем большое количество свободного триптофана. Тотчас же после посева полоску индикаторной бумаги, пропитанную раствором щавелевой кислоты, опускают в пробирку так, чтобы она не упала в питательную среду и не касалась бы ее поверхности. Для этого верхнюю треть бумажной полоски принимают пробкой к горлышку пробирки. Посевы инкубируют в термостате 24 - 48 часов при 37°С. Образование индола в бульоне сопровождается окрашиванием нижнего конца индикаторной бумаги в слабо розовый цвет, более заметный в проходящем свете. Более чувствительным индикатором на индол является реактив Эрлиха (спиртовой раствор парадиметиламидобензальдегида с хлороводородной кислотой). Определение проводят следующим образом: в пробирку с культурой бактерий прибавляют 2-3 мл эфира, содержимое энергично перемешивают и добавляют несколько капель реактива Эрлиха. Окрашивание эфирного слоя в малиново-красный цвет свидетельствует о положительной реакции на индол.
2.3. Определение сероводорода. Петлю исследуемой культуры микробов засевают в пробирку с МПБ или бульоном Хоттингера. Тотчас же после посева в пробирку вносят пропитанную уксуснокислым свинцом индикаторную бумагу на определение сероводорода. В положительных случаях образующийся в культуре сероводород вступает в соединение с бесцветным уксуснокислым свинцом, превращаясь в сернокислый свинец, который придает индикаторной бумаге черно-бурое окрашивание.
Образование сероводорода и индола в культуре определяют одновременно. С этой целью в пробирку с засеянным бульоном вносят одновременно две индикаторные бумаги: на индол и сероводород. Для того чтобы индикаторные бумаги не упали в питательную среду и не касались бы ее поверхности, верхнюю треть бумажных полосок плотно прижимают к стенке пробирки пробкой.
Окончательный учет результатов на образование индола и сероводорода производят на 7-10-й день после произведенного посева, так как процесс ферментативного расщепления белка и образования конечных продуктов распада происходит иногда в течение длительного времени.
3. Окислительно-восстановительные ферменты. В культуре микроорганизмов могут быть обнаружены окислительно-восстановительные ферменты, связанные главным образом с дыхательной функцией.
3.1. Для выявления ферментов дегидраз и определения их активности в практике микробиологических исследований предложен метод, основанный на введении в питательную среду органической краски, выполняющей роль акцептора водорода. В результате присоединения водорода краситель восстанавливается, превращаясь в бесцветное соединение, называемое лейкобазой. Последнее при обильном доступе кислорода может вновь окислиться и приобрести свой прежний цвет.
В качестве акцептора водорода используют метиленовую синь, лакмусовую настойку, малахитовую зелень, индигокармин, нейтральрот и др. Для выявления редуцирующих свойств микроба указанные красители добавляют к обычным питательным средам: МПБ, МПА, молоку.
Один и тот же вид микроба ведет себя неодинаково по отношению к краскам разного состава. Это свойство микроба использовано в микробиологической практике в качестве дифференциального признака. Бактерии брюшного тифа редуцируют метиленовую синь, но не редуцируют лакмуса и не изменяют нейтральрот в противоположность кишечной палочке, которая остается нейтральной в отношении метиленовой сини, но восстанавливает лакмус и нейтральрот.
3.2. Определение фермента каталазы. Некоторые микроорганизмы, принадлежащие к группе аэробов, в процессе дыхания образуют перекись водорода, являющуюся клеточным ядом. Количество перекиси водорода в культуре никогда не достигает высоких концентраций, так как по мере образования перекись разлагается на воду и молекулярный кислород при участии фермента каталазы.
Определением наличия каталазы наряду с изучением других биохимических признаков пользуются при определении вида и дифференциации разновидностей патогенных микробов, выделенных из организма больного и объектов внешней среды. На предметное стекло наносят каплю 1-3 % раствора пероксида водорода и вносят в нее петлю с бактериальной культурой. Каталаза разлагает пероксид водорода на кислород и воду. Выделение пузырьков О2 свидетельствует о наличии у данного вида бактерий фермента каталазы.
Результаты работ по идентификации выделенной культуры протоколируют (табл. 2).
Таблица 2. Характеристика культуры по морфологическим и физиологическим признакам (форма протокола)
| Морфология клеток бактерий | Окраска по Граму и др. методами | Характер роста | Род и вид культуры | |||||||||
| колония | культуры на питательном | ферментация | образо-вание | |||||||||
| бульоне | агаре | глюкозы | лактозы | сахарозы | маннозы | маннита | индола | желатина | ||||
В бактериологической практике иногда ограничиваются изучением сахаролитических и протеолитических признаков исследуемых бактерий, если это является достаточным для их идентификации. В необходимых случаях проводят изучение других признаков, например способности к восстановлению нитратов, карбоксилированию аминокислот, образованию оксидазы, плазмокоагулазы, фибринолизина и других ферментов, а также определение антигенной структуры, чувствительности к фагам, вирулентности и т. д.
Этапы выделения и идентификации чистой культуры бактерии представлены на схеме 1.
Выделение и идентификация чистой культуры бактерии
 |
Примечания 1. Исследуемый материал перед посевом с целью освобождения от сопутствующей микрофлоры иногда подвергают нагреванию до 80 0С для выделения спорообразующих бактерий, обработке кислотой – для выделения кислотоустойчивых бактерий и т.п. 2. Условия инкубации посевов зависят от физиологических особенностей бактериальной культуры, поэтому аэробные бактерии выращивают в присутствии кислорода воздуха, анаэробные бактерии – бескислородной среде: некоторые бактерии лучше растут при повышенном содержании СО2.
Схема 1.
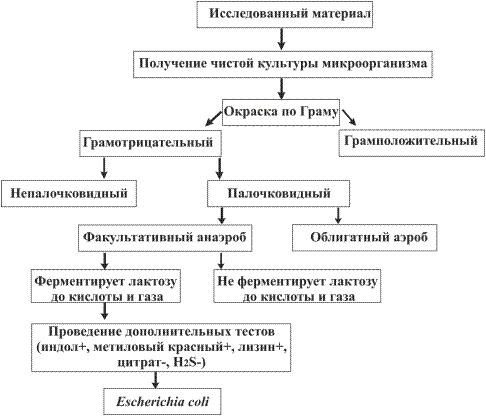
Рис. 14. Пример идентификации неизвестного микроорганизма классическими микробиологическими методами.
 2020-05-11
2020-05-11 946
946






